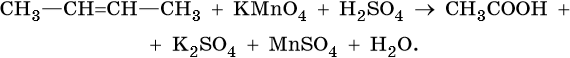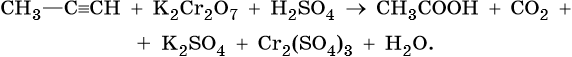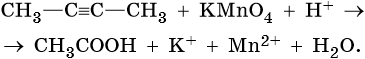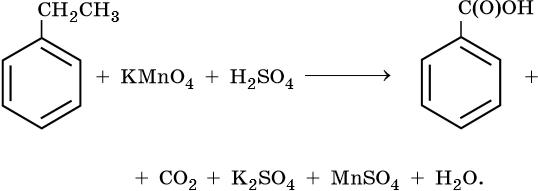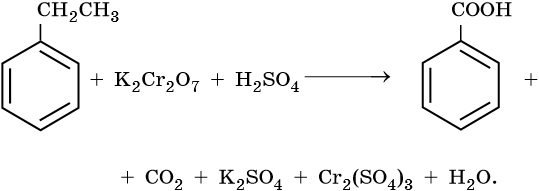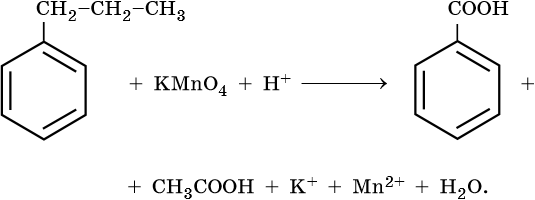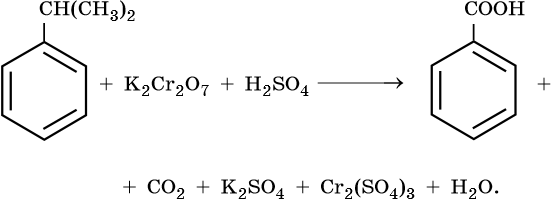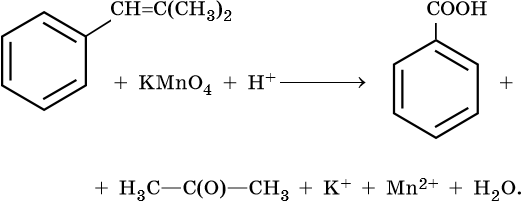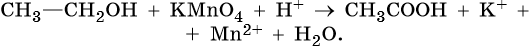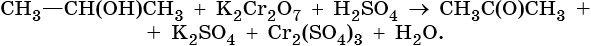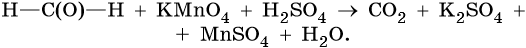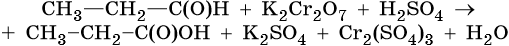Тренировочные задания. Окислительно-восстановительные реакции с участием органических веществ
1. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
2. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
3. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
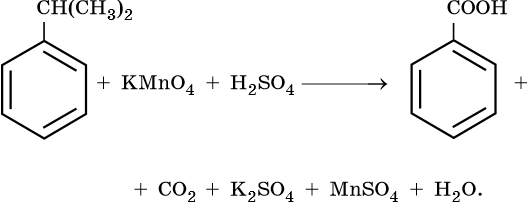
4. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
5. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
6. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
7. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
8. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
9. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
10. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
11. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
12. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
13. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
14. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
Источник
Тренажер. Окислительно-восстановительные реакции
Тренажер по теме: Окислительно-восстановительные реакции (задание С1 ЕГЭ по химии).
Подборка заданий С1
Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель:
РЕШЕНИЯ
2Cr +6 + 6ē → 2Cr +3 1 восстановление
S -2 – 2ē → S 0 3 окисление
H2S – восстановитель за счет S -2
2. 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O
Cl2 0 – 10е → 2Cl +5 1 окисление
Cl2 0 + 2е → 2Cl -1 5 восстановление
Cl2 – окислитель и восстановитель
3. 3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Si 0 – 4e → Si +4 1 окисление
N +5 + 1е ® N +4 4 восстановление
Si 0 – восстановитель
HNO3 – окислитель за счет N +5
4. 2Cr +3 Cl3 + 3 H2O2 1- + 10 NaOH = 2 Na2Cr +6 O4 + 6 NaCl + 8 H2O -2
Cr +3 — 3ē → Cr +6 2 окисление
O2 1- + 2ē → 2O -2 3 восстановление
CrСl3 (Cr +3 ) – восстановитель,
S +6 + 8 е = S -2 1 окисление
2I -1 — 2 е = I 0 2 4 восстановление
HI – восстановитель за счет I -1 H2SO4 – окислитель за счет S +6
Mn +7 + 5e → Mn +2 2 восстановление
2O -1 – 2e → O2 0 5 окисление
KMnO4 – окислитель за счет Mn +7
H2O2 – восстановитель за счет O -1
2O -1 -2e→ O 0 2 5 окисление
Mn +7 +5e→Mn +2 2 восстановление
Rb2O2 – восстановитель за счет O -1
RbMnO4 – окислитель за счет Mn +7
Mn +7 +5е → Mn +2 2 восстановление
Sn +2 — 2е → Sn +4 5 окисление
KMnO4 – окислитель за счет Mn +7
SnSO4 – восстановитель за счет Sn +2
P — 3 – 8 е → P +5 5 окисление
Mn +7 + 5 е → Mn +2 8 восстановление
PH3 – восстановитель за счет P -3
KMnO4 – окислитель за счет Mn +7
10. 2Cr +3 Cl3 + 3H2O -1 2 + 10KOH → 2K2Cr +6 O4 + 6KCl + 8H2O -2
Cr +3 – 3е → Cr +6 2 окисление
2O -1 + 2е → 2O -2 3 восстановление
Cr +3 в составе CrCl3 – восстановитель
O -1 в составе H2O2 – окислитель
2I – – 2 е → I2 0 1 окисление
Mn +6 + 2 е → Mn +4 1 восстановление
KI – восстановитель за счет I2
K2MnO4 – окислитель за счет Mn +6
12. Cr +3 2O -2 3 + 32 + 10NaOH = 2Na +1 2Cr +6 O4 + 6NaBr -1 + 5H2O
Cr +3 -3e → Cr +6 2 окисление
Br 0 2 +2e →2Br -1 3 восстановление
Cr2O3 – восстановитель за счет Cr +3
Br 0 2 – окислитель
Cl +5 + 6e → Cl -1 1 восстановление
2Fe +2 – 2e → 2Fe +3 3 окисление
HClO3 – окислитель за счет Cl +5
FeSO4 – восстановитель за счет Fe +2
2N +1 – 2e = 2N +2 5 окисление
Mn +7 + 5e = Mn +2 2 восстановление
KMnO4 – окислитель за счет Mn +7
N2O – восстановитель за счет N +1
N +5 +2e N +3 3 восстановление
2Fe +3 -6e 2Fe +6 1 окисление
Fe2O3 – восстановитель за счёт Fe +3
KNO3 – окислитель за счёт N +5
Mn +4 – 2e → Mn +6 3 окисление
Cl +5 +6e →Cl -1 1 восстановление
KClO3 – окислитель за счет Cl +5
MnO2 – восстановитель за счет Mn +4
Cr +6 + 3e → Cr +3 1 восстановление
Fe +2 — 1e → Fe +3 3 окисление
CrO3 – окислитель за счет Cr +6
FeSO4 – восстановитель за счет Fe +2
O -1 + 1e → O -2 2 восстановление
2I -1 – 2e → 2I 0 1 окисление
Na2O2 окислитель за счет O -1
KI – восстановитель за счет I -1
2S -– 2 – 4 е → 2S 0 3 окисление
Mn +7 + 3 е → Mn +4 4 восстановление
CS2 – восстановитель за счет S -– 2
KMnO4 – окислитель за счет Mn +7
S -2 -2e → S 0 5 окисление
Mn +7 +5e → Mn +2 2 восстановление
H2S – восстановитель за счет S -– 2
KMnO4 – окислитель за счет Mn +7
21. 14FeCl2 + 2KClO4 + 16HCl → 14FeCl3 + Cl2 + 2KCl + 8H2O
Fe +2 – 1е → Fe +3 14 окисление
2Cl +7 + 14е → Cl2 0 1 восстановление
FeCl2 – восстановитель за счет Fe +2
KClO4 – окислитель за счет Cl +7
Cl +1 + 2e → Cl -1 1 восстановление
2I -1 – 2e → I2 1 окисление
NaOCl – окислитель за счет Cl +1
KI – восстановитель за счет I -1
2Fe +2 – 2e = 2Fe +3 5 окисление
Mn +7 + 5e = Mn +2 2 восстановление
Fe SO4 – восстановитель за счет Fe +2
KMnO4 – окислитель за счет Mn +7
Cu 0 ─ 2e → Cu +2 3 окисление
N +5 +3e → N +2 2 восстановление
Cu 0 – восстановитель
KN +5 O3 – окислитель за счет N +5
2Cr +6 + 8 e→2Cr +2 3 восстановление
2Al 0 – 6e → 2Al +3 4 окисление
Al 0 – восстановитель
26. 3Zn + Na2SO3 + 8HCl = 3ZnCl2 + H2S + 2NaCl + 3H2O
Zn 0 – 2ē → Zn +2 3 окисление
S +4 + 6ē → S -2 2 восстановление
Zn 0 –восстановитель,
Na2SO3 – окислитель за счет S +4
Sn +2 -2e = Sn +4 3 окисление
2Cr +6 + 6e = 2Cr +3 1 восстановление
SnCl2 – восстановитель за счет Sn +2
Fe +2 – e → Fe +3 6 окисление
2N +3 + 6e → N2 0 1 восстановление
FeCl2 – восстановитель за счёт Fe +2
HNO2 – окислитель за счёт N +3
Cr + 3 – 3 е → Cr +6 2 окисление
Br2 0 + 2 е → 2Br — 3 восстановление
K3[Cr +3 (OH)6] – восстановитель за счет Cr +3
30. 2Mn +4 O2 + 3NaBi +5 O3 + 4HNO3 → 2NaMn +7 О4 + 3Bi +3 ONO3 + NaNO3 + 2H2O
Mn + 4 – 3 е → Mn +7 2 окисление
Bi +5 + 2 е → Bi +3 3 восстановление
NaBiO3 – окислитель за счет Bi +5
MnO2 – восстановитель за счет Mn +4
31. KN +5 O3 +3 Fe +2 Cl2 + 4HCl → N +2 O + 3Fe +3 Cl3 +KCl + 2H2O
N +5 +3e → N +2 1 восстановление
Fe +2 –1e → Fe +3 3 окисление
KNO3 – окислитель за счет N +5
FeCl2 – восстановитель за счет Fe +2
2Br -1 –2ē → Br 0 2 1 окисление
Mn +4 +2ē → Mn +2 1 восстановление
MnO2– окислитель за счет Mn +4
КBr– восстановитель за счет Br -1
N + 3 – 2 е → N +5 3 окисление
2Cr +6 + 6 е → 2Cr +3 1 восстановление
NaNO2 – восстановитель за счет N + 3
S +4 –2e — → S +6 3 окисление
Cr +6 + 3 e — → Cr +3 2 восстановление
Na2SO3 – восстановитель за счет S +4
Cr +3 –3e — → Cr +6 2 окисление
N +5 + 2 e — → N +3 3 восстановление
Cr2O3 – восстановитель за счет Cr +
KNO3 — окислитель за счет N +5
2Cr +6 + 6е → 2Cr +3 1 восстановление
2Cl -1 – 2e → Cl2 0 3 окисление
HCl – восстановитель за счет Cl -1
Br2 0 + 2е →2 Br -1 1 восстановление
Mn +2 – 2e → Mn +4 1 окисление
Br2 0 – окислитель,
MnSO4 2 – восстановитель за счёт Mn +
2I -1 – 2 е → I 0 2 4 окисление
S +6 +8е → S -2 1 восстановление
KI– восстановитель за счёт I -1
H2SO4 – окислитель за счёт S +6
39. 3Zn + KClO3 + 6КОН + 3H2O = 3K2[Zn(OH)4] + КСl
Zn 0 – 2e → Zn 2+ 3 окисление
Cl +5 + 6e → Cl -1 1 восстановление
Zn 0 – восстановитель
KClO3 – окислитель за счет Cl +5
Sn +2 -2е → Sn +4 3 окисление
2Cr +6 + 6е → 2Cr +3 1 восстановление
SnCl2 – восстановитель за счет Sn +2
Pb +4 +2е = Pb +2 5 восстановление
Mn +2 – 5е = Mn +7 2 окисление
PbO2 – окислитель за счёт Pb +4
Mn(NO3)2 – восстановитель за счёт Mn +2
2Cr +3 – 6e — → 2Cr +6 1 окисление
Cl +5 + 6e — → Cl -1 1 восстановление
Cr2 +3 (SO4)3 – восстановитель за счёт Cr +3
KCl +5 O3 – окислитель за счёт Cl +5
2Cu +1 – 2 e →2Cu +2 5
Mn +7 +5 e → Mn +2 2
Cu2O – восстановитель за счет Cu +1
KMnO4 – окислитель за счет Mn +7
Cu +2 + 2 e → Cu 0 5
P 0 – 5 e → P +5 2
P 0 – восстановитель
CuSO4 – окислитель за счет Cu +2
Источник
Задачи к разделу Окислительно-восстановительные реакции
В данном разделе собраны задачи по теме Окислительно-восстановительные реакции. Приведены примеры задач на составление уравнений реакций, нахождение окислительно-восстановительного потенциал, и константы равновесия ОВР и другие.
Задача 1. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня: NH3, CO, SO2, K2MnO4, Сl2, HNO2. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
Решение.
Простые вещества, атомы которых не могут отдать электрон, а могут только присоединить его в реакциях являются только окислителями. Из простых веществ только окислителем может быть фтор F2, атомы которого имеют наивысшую электроотрицательность. В сложных соединениях – если атом, входящий в состав этого соединения (и меняющий степень окисления) находится в своей наивысшей степени окисления, то данное соединение будет обладать только окислительными свойствами.
Из предложенного списка соединений, нет веществ, которые обладали бы только окислительными свойствами, т.к. все они находятся в промежуточной степени окисления.
Наиболее сильный окислитель из них – Cl2, но в реакциях с более электроотрицательными атомами будет проявлять восстановительные свойства.
Составим электронные уравнения:
N +5 +3e — = N +2 | 8 окислитель
S -2 — 8e — = S +6 | 3 восстановитель
Сложим два уравнения
8N +5 +3S -2 — = 8N +2 + 3S +6
Подставим коэффициенты в молекулярное уравнение:
Задача 2. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составьте уравнения реакций HNO2: а) с бромной водой; б) с HI; в) с KMnO4. Какую функцию выполняет азотистая кислота в этих реакциях?
Решение.
HN +3 O2 — Степень окисления азота в азотистой кислоте равна +3 (промежуточная степень окисления). Азот в этой степени окисления может как принимать, так и отдавать электроны, т.е. может являться как окислителем, так восстановителем.
N +3 – 2 e = N +5 | 1 восстановитель
Br2 0 + 2 e = 2Br — | 1 окислитель
N +3 + Br2 = N +5 + 2Br —
б) HNO2 + 2HI = I2 + 2NO + 2H2O
N +3 + e = N +2 | 1 окислитель
2I — — 2 e = I 2 | 1 восстановитель
N +3 + 2I — = N +2 + I2
N +3 – 2 e = N +5 | 5 восстановитель
Mn +7 + 5 e = Mn +2 | 2 окислитель
5N +3 + 2Mn +7 = 5N +5 + 2Mn +2
Задача 3. Определите степени окисления всех компонентов, входящих в состав следующих соединений: HСl, Cl2, HClO2 , HClO3 , Cl2O7 . Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьте коэффициенты в уравнении реакции:
КСlO3 → КС1 + КСlO4.
Укажите окислитель и восстановитель.
Решение.
Хлор может проявлять степени окисления от -1 до +7.
Соединения, содержащие хлор в его высшей степени окисления, могут быть только окислителями, т.е. могут только принимать электроны.
Соединения, содержащие хлор в его низшей степени окисления, могут быть только восстановителями, т.е. могут только отдавать электроны.
Соединения, содержащие хлор в его промежуточной степени окисления, могут быть как восстановителями, так и окислителями, т.е. могут отдавать, так и принимать электроны.
H +1 Сl -1 , Cl 0 2, H +1 Cl +3 O2 -2 , H +1 Cl +5 O3 -2 , Cl2 +7 O7 -2
Таким образом, в данном ряду
Только окислитель — Cl2O7
Только восстановитель – HСl
Могут быть как окислителем, так и восстановителем — Cl2, HClO2 , HClO3
КСlO3 → КС1 + КСlO4.
Составим электронные уравнения
Cl +5 +6e — = Cl — | 2 | 1 окислитель
Cl +5 -2e — = Cl +7 | 6 | 3 восстановитель
Расставим коэффициенты
4Cl +5 = Cl — + 3Cl +7
Задача 4. Какие из приведенных реакций являются внутримолекулярными? Расставьте коэффициенты в уравнениях реакций. Укажите восстановитель, окислитель.
Решение.
В реакциях внутримолекулярного окисления-восстановления перемещение электронов происходит внутри одного соединения, т.е. и окислитель и восстановитель входят в состав одного и того же сложного вещества (молекулы)
а) 2KNO3 = 2KNO2 + O2 — внутримолекулярная ОВР
N +5 +2e — = N +3 | 2 окислитель
2 O -2 -4 e — = O2 0 | 1 восстановитель
2N +5 + 2O -2 = 2N +3 + O2 0
б) 3Mq + N2 = Mq3N2 — межмолекулярная ОВР
N2 +6e — = 2N -3 | 2 | 1 окислитель
Mg 0 -2 e — = Mg +2 | 6 | 3 восстановитель
N2 + 3Mg 0 = 2N -3 + 3Mg +2
в) 2KClO3 = 2KCl + 3O2 — внутримолекулярная ОВР
Cl +5 +6e — = Cl — | 4 | 2 окислитель
2 O -2 -4 e — = O2 0 | 6 | 3 восстановитель
2Cl +5 + 6O -2 = 2Cl — + 3O2 0
Задача 5. Какие ОВР относятся к реакциям диспропорционирования? Расставьте коэффициенты в реакциях:
а) Cl2 + KOH = KCl + KClO3 + H2O;
б) KClO3 = KCl + KClO4 .
Решение.
В реакциях диспропорционирования окислителем и восстановителем являются атомы одного и того же элемента в одинаковой степени окисления (обязательно промежуточной). В результате образуются новые соединения, в которых атомы этого элемента обладают различной степенью окисления.
а) 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O;
Cl2 0 +2e — = 2Cl — | 10| 5 окислитель
Cl2 0 -10e — = 2Cl +5 | 2 | 1 восстановитель
5Cl2 0 + Cl2 0 = 10Cl — + 2Cl +5
3Cl2 0 = 5Cl — + Cl +5
б) 4KClO3 = KCl + 3KClO4
Cl +5 +6e — = Cl — | 2 | 1 окислитель
Cl +5 -2 e — = Cl +7 | 6 | 3 восстановитель
4Cl +5 = Cl — + 3Cl +7
Задача 6. Составьте электронные уравнения и подберите коэффициенты ионно-электронным методом в реакции
Решение.
MnO4 — + 8H + +5e — = Mn 2+ + 4H2O | 2 окислитель
NO2 — + H2O — 2e — = NO3 — + 2H + | 5 восстановитель
Сложим две полуреакции, умножив каждую на соответствующий коэффициент:
После сокращения идентичных членов, получаем ионное уравнение:
Подставим коэффициенты в молекулярное уравнение и уравняем его правую и левую части:
Задача 7. Определите методом электронного баланса коэффициенты в уравнениях окислительно-восстановительных реакций:
Решение.
Составим электронные уравнения
Zn 0 – 2 e = Zn 2+ | 8 | 4 | восстановитель
N +5 + 8 e = N 3- | 2 | 1 | окислитель
4Zn 0 + N +5 = 4Zn 2+ + N 3-
Составим электронные уравнения
Zn 0 – 2 e = Zn 2+ | 2 | 1 восстановитель
S +6 + 2 e = S +4 | 2 | 1 окислитель
Zn 0 + S +6 = Zn 2+ + S +4
Задача 8. Можно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях:
а) 2F — -2e — = F2, E 0 = 2,85 В
б) 2Сl — -2e — = Cl2, E 0 = 1,36 В
в) 2Br — -2e — = Br2, E 0 = 1,06 В
г) 2I — -2e — = I2, E 0 = 0,54 В
Стандартный окислительно-восстановительный потенциал системы
Cr2O7 2- + 14H + + 6e — = 2Cr 3+ + 7H2O равен E 0 =1,33 В
Решение.
Для определения возможности протекания ОВР в прямом направлении необходимо найти ЭДС гальванического элемента:
ЭДС = Е 0 ок — Е 0 восст
Если найденная величина ЭДС > 0, то данная реакция возможна.
Итак, определим, можно ли K2Cr2O7 использовать в качестве окислителя в следующих гальванических элементах:
Таким образом, в качестве окислителя дихромат калия можно использовать только для процессов:
2Br — -2e — = Br2 и 2I — -2e — = I
Задача 9. Вычислите окислительно-восстановительный потенциал для системы
MnO4 — + 8H + +5e — = Mn 2+ + 4H2O
Если С(MnO4 — )=10 -5 М, С(Mn 2+ )=10 -2 М, С(H + )=0,2 М.
Решение.
Окислительно-восстановительный потенциал рассчитывают по уравнению Нернста:
В приведенной системе в окисленной форме находятся MnO4 — и H + , а в восстановленной форме — Mn 2+ , поэтому:
E = 1,51 + (0,059/5)lg(10 -5 *0,2/10 -2 ) = 1,46 В
Задача 10. Рассчитайте для стандартных условий константу равновесия окислительно-восстановительной реакции:
Решение.
Константа равновесия K окислительно-восстановительной реакции связана с окислительно-восстановительными потенциалами соотношением:
lgK = (E1 0 -E2 0 )n/0,059
Определим, какие ионы в данной реакции являются окислителем и восстановителем:
MnO4 — + 8H + +5e — = Mn 2+ + 4H2O | 2 окислитель
Br — + H2O — 2e — = HBrO + H + | 5 восстановитель
Общее число электронов, принимающих участие в ОВР n = 10
E1 0 (окислителя) = 1,51 В
E2 0 (восстановителя) = 1,33 В
Подставим данные в соотношение для К:
lgK = (1,51 — 1,33 )10/0,059
K = 3,22*10 30
Примеры ОВР с ответами приведены также в разделе тест Окислительно-восстановительные реакции
Источник