- Чего боится миома?
- Миома боится хирургов
- Миома немного боится лекарств
- Миома боится остаться без кислорода
- Миома боится климакса
- Чего не боится миома?
- К чему миома равнодушна?
- «Голодная» миома
- «Мама запрещает мне ходить на акваэробику. Она утверждает, что такие занятия могут спровоцировать рост миомы и даже вызвать кровотечения. Права ли она?» Ольга Н., Москва
- «Читала, что миома матки — это эндокринное заболевание. Связано ли это оно с болезнями щитовидной железы? Как совместить лечение?» Ольга Лаврова, Томск
- «Одна моя знакомая утверждает, что вылечила миому настоями цветка оносмы. Может ли это быть так? И если да – то как его правильно применять?» Г.Ж., Алматы
- «Во время ежегодной диспансеризации у меня обнаружили миому размером 8 мм. Доктор сказала, что лечить не надо. Может быть она не права, и мне стоит поискать другого врача, все-таки миома – дело серьезное?» Марьяна, Клин
- «Год назад мне удалили субмукозную миому матки при помощи гистерорезектоскопии. Cейчас на этом месте опять видно образование. Врач предлагает вновь сделать ту же операцию. И что же теперь каждый год придется обращаться к хирургу?» Т.Н., Москва
- «У нас в семье все женщины страдают от миомы: бабушка, мама, старшая сестра. Я вижу, скольких усилий им стоит держать свой недуг под контролем. И очень хочу избежать этой участи. Есть ли какие-то эффективные меры профилактики?» Мария Вебер, Минск
- «Узнала, что сейчас можно удалить миому без операции – при помощи эмболизации. Но говорят, что после этого всегда поправляются и несколько месяцев держится температура и болит живот. Действительно ли это так?» Ольга Мелискина, Санкт-Петербург
- Неоперативные методы лечения миомы матки
Чего боится миома?
Платон сравнил матку со зверем, который живет в теле женщины. «Сбесившись», он начинает «бегать» по организму и вызывать различные симптомы. Так появился термин «истерия» — тысячелетия назад считалось, что в возникновении этого состояния повинна именно «бешеная» матка, которую современники Гиппократа называли hystera («хистера»).
Времена античности давно прошли, но некоторые мифы существуют до сих пор. Современный «непонятный зверек» в теле женщины, с которым плохо знакомы даже некоторые гинекологи — миома матки. Эта «доброкачественная опухоль» окутана густым туманом из заблуждений и домыслов.
В последние десятилетия в понимании миомы многое изменилось. То, что раньше даже для врачей казалось самим собой разумеющимся, сегодня — не более чем пережиток прошлого. Попробуем разобраться, что же это за зверь такой — миома, и чего она боится.
Миома боится хирургов
В частности, тех, которые занимаются миомэктомиями (удалением миом) и гистерэктомиями (удалением матки). Сама матка тоже боится таких операций, да и весь организм от них не в восторге. Иногда хирургическое вмешательство по поводу миомы становится оптимальным решением, но в большинстве случаев это — стрельба из пушки по мухам. Стоит ли готовить тяжелую артиллерию там, где можно обойтись мухобойкой? И насекомых нет, и стены в доме целы (впрочем, всё по порядку, о «мухобойках» против миом поговорим ниже).
Главные недостатки операции:
- Собственно, то, что это — операция. С наркозом и со всеми вытекающими рисками.
- В 7-14 случаях из ста через год после операции миома вырастает снова.
- Риск рецидива можно снизить, но для этого придется принимать гормоны. Чему организм тоже не всегда бывает рад.
- Одно из осложнений после операции — спайки в малом тазу. Из-за них могут возникнуть проблемы с зачатием ребенка.
- Если врач предлагает удалить миому вместе с маткой, то стоит задуматься о последствиях. Они могут оказаться серьезнее, чем проблемы, которые вызывала сама миома. Даже если женщина уже не планирует заводить детей.
Вывод: Миома боится хирургического вмешательства, но не боятся его, пожалуй, только гинекологи. Недостатков у этого метода лечения хватает. Обычно к операции прибегают, когда есть большие узлы, и женщина планирует беременность в самое ближайшее время.
Миома немного боится лекарств
Если быть точнее, легкий страх она испытывает всего перед одним препаратом — блокатором гестагеновых рецепторов Улипристалом (он же Эсмия). При правильном курсе лечения около 60% миоматозных узлов уменьшаются. Однако эффект различается у разных женщин. Ученые не могут точно сказать, надолго ли лекарство поможет уменьшить миому.
Прочие гормональные препараты и спирали «Мирена» миоме нипочем. Как бы ни хотелось верить в обратное некоторым гинекологам «старой школы».
Миома боится остаться без кислорода
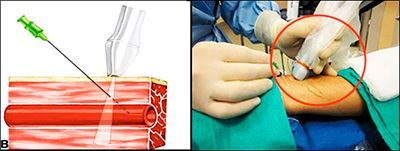
Об этом врачи и ученые знают уже давно (с 70-х годов прошлого века), но некоторые до сих пор отказываются верить. Существует такая процедура — эмболизация маточных артерий, когда в сосуд, питающий миому, через катетер вводят специальные микросферы. Они перекрывают просвет артерии, миома остается без кислорода и питательных веществ, «усыхает» и по сути превращается в соединительную ткань. Была большая виноградина, превратилась в маленькую изюминку. А то и вовсе отделилась от стенки матки и «вышла» через влагалище.
В настоящее время американские врачи считают эмболизацию маточных артерий (сокращенно — ЭМА) золотым стандартом лечения миомы, потому что она имеет ряд преимуществ:
- Рецидивов, в отличие от хирургического лечения, практически не бывает.
- Если миома вызывала симптомы, после ЭМА они полностью проходят у 99% женщин.
- Процедура длится 15-30 минут. Нет никакого разреза. Врачу нужно лишь проколоть кожу, чтобы ввести в сосуд катетер. Наркоз тоже не нужен.
Вывод: Эмболизация маточных артерий — та самая процедура, которую современные эксперты рекомендуют применять у большинства женщин с миомой. Возможно, вы слышали другую точку зрения, но это — лишь точка зрения. Эффективность и безопасность ЭМА доказаны научно.
Миома боится климакса
И поэтому женщин старшего возраста нужно лечить не всегда. Когда в организме снижается уровень гормонов, что неминуемо происходит у здоровых женщин после менопаузы, узлы перестают расти.
Чего не боится миома?
Миоматозные узлы не боятся народных средств, БАДов, гомеопатии и всевозможных методов альтернативной медицины. Пока женщина ставит эксперименты над своим здоровьем, вместо того чтобы обратиться к врачу, миома может сильно вырасти. Потребуется более серьезное лечение.
К чему миома равнодушна?
Классически считается, что миому нужно «носить» в своем теле аккуратно, как бомбу замедленного действия, соблюдать массу ограничений. У современных ученых для женщин хорошие новости: скорость роста миомы почти не зависит от образа жизни. С миомой можно:
- заниматься сексом;
- заниматься спортом (если миома не приводит к обильным месячным и не настолько огромна, что сдавливает соседние органы);
- принимать оральные контрацептивы — но только как средство контрацепции, от миомы они не лечат;
- принимать ванну и ходить в сауну;
- делать массаж;
- есть всё, что вам нравится (при обильных месячных нужно позаботиться, чтобы в рационе присутствовало достаточное количество железа).
И строго говоря, миому нельзя назвать опухолью, даже доброкачественной. Рак в ней развивается не чаще, чем в здоровом миометрии (мышечном слое стенки матки). Поэтому бояться её не стоит. Но наблюдаться у гинеколога нужно однозначно.
Источник
«Голодная» миома
«Мама запрещает мне ходить на акваэробику. Она утверждает, что такие занятия могут спровоцировать рост миомы и даже вызвать кровотечения. Права ли она?» Ольга Н., Москва
— Чтобы ответить на ваш вопрос, нужно знать, сколько у вас узлов, какого они размера, а главное — где расположены. Если они находятся внутри матки, то любой спорт, в том числе и аэробика, может вызвать болезненные ощущения и кровотечения. Матка — мышечный орган, и интенсивная физическая нагрузка на организм нередко приводит к ее сокращениям. Отсюда и все неприятности.
Поэтому прежде чем отправляться на занятия, нужно проконсультироваться с врачом и сделать УЗИ органов малого таза . Он же и посоветует вам, каким видом спорта лучше заняться. Вполне возможно, вам придется лишь сменить довольно энергичную акваэробику на более спокойное плавание.
«Читала, что миома матки — это эндокринное заболевание. Связано ли это оно с болезнями щитовидной железы? Как совместить лечение?» Ольга Лаврова, Томск
— Миома — это доброкачественная опухоль, которая формируется из мышечного слоя матки. Причины ее появления — нарушение баланса яичниковых гормонов. Поэтому это заболевание и считается эндокринным. Но с болезнями щитовидной железы оно напрямую не связано: там другие гормоны и другие «законы». Заболевания щитовидной железы нужно лечить, выполняя назначения врача-эндокринолога.
«Одна моя знакомая утверждает, что вылечила миому настоями цветка оносмы. Может ли это быть так? И если да – то как его правильно применять?» Г.Ж., Алматы
— Многие уповают на народную медицину, пытаясь избежать операций или гормонального лечения миомы. Психологически такие действия понятны — женщины стремятся решить проблему, по возможности защитив себя от нежелательных последствий. Но, к сожалению, «безвредные» народные методы могут оказать «медвежью услугу». И принести гораздо больший вред, чем та же операция или гормоны. Так как при лечении травами будет упущено драгоценное время. И потом придется проводить уже более серьезные операции, чем это можно было бы сделать раньше. Как бы ни хотелось, но ни фитотерапия, ни гомеопатия при миоме не помогают.
А что касается вашей знакомой, то здесь нужно еще разбираться. Вполне возможно вы просто не в курсе, и ей помогло другое лечение, которое она применяла одновременно с фитотерапией. Или же в силу возраста и снижения гормонального фона миома исчезла сама. Настоятельно советую на будущее: меньше слушать знакомых, а по всем вопросам консультироваться с доктором.
«Во время ежегодной диспансеризации у меня обнаружили миому размером 8 мм. Доктор сказала, что лечить не надо. Может быть она не права, и мне стоит поискать другого врача, все-таки миома – дело серьезное?» Марьяна, Клин
— Вам повезло. Миомы маленьких размеров без проявлений, а именно к таким относится и ваша — не требуют лечения. За ними нужно лишь регулярно наблюдать. Один раз в шесть месяцев необходимо делать УЗИ органов малого таза при помощи абдоминального и влагалищного датчиков.
В дальнейшем, если будет зафиксирован рост и появятся жалобы, и врач сочтет нужным, он назначит лечение. Сегодня для этого используются низкодозированные гормональные препараты или внутриматочные гормональные системы. Первые можно применять с самого раннего возраста и нерожавшим женщинам. Вторые чаще используются зрелыми дамами, имеющими хотя бы одного ребенка. Принцип здесь один — подавить выработку собственных гормонов, чтобы замедлить рост узлов миомы. Как показывает практика, если начать такое лечение своевременно и проводить его регулярно, операции вполне можно избежать.
«Год назад мне удалили субмукозную миому матки при помощи гистерорезектоскопии. Cейчас на этом месте опять видно образование. Врач предлагает вновь сделать ту же операцию. И что же теперь каждый год придется обращаться к хирургу?» Т.Н., Москва
— Гистерорезектоскопия — это органосохраняющий метод лечения. И хотя эта операция проводится под общим наркозом, побочные эффекты минимальны: матка сохраняется, нет спаек и шрамов на животе.
К сожалению, миома может появиться вновь. Ведь механическое удаление узла не влияет на основную причину — гормональный дисбаланс. Рано или поздно, он вновь заявляет о себе. И чем моложе женщина, тем с большей вероятностью это происходит. С возрастом снижается уровень женских половых гормонов, и риск появления нового узла становится меньше.
А пока, особенно если вы еще планируете беременность, не сомневайтесь и без колебаний соглашайтесь на вторую операцию.
«У нас в семье все женщины страдают от миомы: бабушка, мама, старшая сестра. Я вижу, скольких усилий им стоит держать свой недуг под контролем. И очень хочу избежать этой участи. Есть ли какие-то эффективные меры профилактики?» Мария Вебер, Минск
— Действительно, миома довольно часто передается по наследству. Но часто — не значит, всегда. Науке известно много случаев, когда долгая семейная история с наследованием миомы резко прекращалась. И, наоборот, без каких-либо генетических предпосылок миома вдруг появлялась у женщины и затем передавалась по наследству ее дочери и внучке. К сожалению, миома — дама капризная и непредсказуемая. Мы точно не знаем всех «черт ее характера», поэтому и не можем выработать эффективные меры защиты от нее. Но некоторые провоцирующие факторы все же известны.
В первую очередь, это изменения уровня половых гормонов и нарушения иммунитета. Если таковые имеются, нужно регулярно проходить обследования и, если необходимо, лечение. В семьях, где миома — «семейная проблема» желательно искусственно не прерывать беременность. Это может спровоцировать рост опухоли.
Также советую надолго не откладывать рождение детей. Так как показывает статистика, чаще всего миома появляется в возрасте после 30 лет.
И конечно, не забывайте об обследованиях у гинеколога — не реже одного раза в год. Это правило действует для всех, но в вашем случае регулярные визиты к женскому доктору должны войти в привычку.
«Узнала, что сейчас можно удалить миому без операции – при помощи эмболизации. Но говорят, что после этого всегда поправляются и несколько месяцев держится температура и болит живот. Действительно ли это так?» Ольга Мелискина, Санкт-Петербург
- Стоимость: 72 000 руб.
- Продолжительность: от 15 до 50 минут
- Госпитализация: 1 день в стационаре
Под местной анестезией в артерию на бедре вводится тонкий катетер. Под рентген-контролем врач доводит его до сосудов, питающих миому, и вводит в них особое вещество. Оно перекрывает ток крови. Миома, лишенная питания, значительно уменьшается. А иногда и исчезает совсем. Операция длится от 20 минут до 2-х часов. Понятно, что за это время можно только лишить питания миому. На то, чтобы дождаться видимого результата, нужно время. Как правило, уже через три месяца узлы заметно уменьшаются.
Конечно, такие действия не могут пройти незамеченными для организма. Обычно, его реакция выражается в болях в нижней части живота, повышении температуры, слабости, усталости и сонливости. В таких случаях следует принимать обезболивающие, много пить и ограничить физическую активность. Неприятные ощущения могут беспокоить периодически в течение 7-дней — 2-х месяцев. Затем все приходит в норму. Но ценность ЭМА заключается в том, что в некоторых случаях применение ЭМА — это единственная возможность сохранить матку и детородную функцию.
А вот на фигуре эта процедура никак не отражается. Так что если вдруг вы заметите какие-либо изменения в сторону увеличения веса, обратите внимание на рацион. Возможно, вы просто «дали слабину» и позволили себе больше, чем обычно.
Подготовила Наталья ЕПИФАНОВА
Журнал «Женское Здоровье», сентябрь 2010 г.
Источник
Неоперативные методы лечения миомы матки
Лейомиома матки — одно из самых распространенных заболеваний у женщин, однако, несмотря на успехи в диагностике миомы матки, до настоящего времени не существует «золотого» стандарта лечения, что обусловлено как нерешенными проблемами патогенеза миомы матк
Лейомиома матки — одно из самых распространенных заболеваний у женщин, однако, несмотря на успехи в диагностике миомы матки, до настоящего времени не существует «золотого» стандарта лечения, что обусловлено как нерешенными проблемами патогенеза миомы матки, так и традиционно сложившимися представлениями «о бесполезности» матки при реализованной репродуктивной функции. Поэтому наиболее распространенным методом лечения миомы матки остается гистерэктомия. Подобный радикализм у большинства больных не обоснован, поскольку практически отсутствует риск озлокачествления и отмечается прогресс в появлении методов, тормозящих рост опухоли и вызывающих регресс симптомов заболевания [1, 4] Использование малоинвазивных и неинвазивных методов лечения на ранних этапах развития миомы матки позволяет остановить развитие заболевания, привести к его регрессу и не допустить в дальнейшем нарушения репродуктивной функции [2, 3].
Эпидемиология. Факторы риска
Частота возникновения миомы матки составляет 15–17% у женщин старше 30 лет и 30–35% у женщин, достигших пременопаузального возраста [1, 5]. Однако в последние годы наблюдается тенденция к «омоложению» миомы матки — возникновение ее у женщин до 30 лет, что обусловлено как совершенствованием диагностики, так и широким распространением «агрессивных» акушерских и гинекологических вмешательств. Частое сочетание миомы матки с доброкачественными заболеваниями эндометрия, эндометриозом осложняет течение заболевания и затрудняет тактику лечения.
Средний возраст выявления миомы матки составляет 32,8 ± 0,47 года, а показания к активному хирургическому лечению появляются примерно к 45 годам. Установлено, что развитие этой опухоли занимает в среднем 5 лет и в 84% случаев узлы являются множественными [1, 5,].
Эпидемиологические исследования выявили ряд факторов риска развития этой опухоли — этнические, генетические, паритет, вредные привычки, питание [1, 7]. У афро-американских женщин встречаемость миомы матки самая высокая, причем возникают в более молодом возрасте, достигают больших размеров и частота анемий выше, особенно по сравнению с кавказскими и азиатскими женщинами. Объяснением служит повышенный уровень циркулирующих эстрогенов по сравнению с женщинами другой расы.
Исследования близнецов и семей выявили генетический фактор риска [1]. Так, вероятность развития этой опухоли значительно выше и возникает в более молодом возрасте у женщин, матери и/или сестры которых страдали этим заболеванием. Недавно был определен фактор наследственности, как предполагают, играющий роль в этиологии опухоли матки. Хотя 50–60% миом матки являются кариотипически нормальными, однако часто встречаются аберрации, которые затрагивают хромосомы 6, 7, 12 и 14 (Gross K. L., 2001). Перестройки в этих хромосомах последовательно влияют на две недавно обнаруженные группы генов белка — HMGIC и HMGIY. Они кодируют те белки, которые, вероятно, играют роль в транскрипции и могут играть свою роль в аномальном росте миом. Однако, несмотря на доказательство наследования, не выявлено, какие именно генные мутации могут привести к развитию данного заболевания, а следовательно, не существует и превентивных мер.
Отсутствие детей и раннее наступление менархе повышает в 2–3 раза риск развития миомы. Причем степень уменьшения риска тем выше, чем больше детей в семье, — так у женщин с тремя доношенными беременностями риск снижается на 50–90%, хотя не выявлено никакой корреляции между возрастом при первых родах и миомами, а также для женщин 45 лет и старше защитный эффект parity не столь очевиден [7]. Объяснить это можно либо более высокой степенью риска вследствие более длительного периода с момента последних родов, либо более длительного периода воздействия стероидных гормонов в целом. Противоречивы данные о действии оральных контрацептивов. Однако в большинстве работ доказано, что применение оральных контрацептивов не повышает риск развития миомы матки. Так же как и нет никаких доказательств увеличения роста и количества миоматозных узлов на фоне приема заместительной гормональной терапии (ЗГТ) (Luoto R., 2002).
Избыточный вес, особенно в сочетании с низкой физической активностью на фоне хронического стресса, повышает риск миомы матки в 2–3 раза, причем прибавка веса после 18 лет влияет более значительно, чем ожирение в детском и пубертатном возрасте. Это объясняется повышенной периферической конверсией в жировых клетках андрогенов в эстрогены под воздействием ароматазы и более высокой биодоступностью факторов роста, типа инсулиноподобного фактора роста-1 (ИПФР-1).
Не выявлено корреляций с курением, хотя теоретически курение могло бы снижать риск миомы матки, поскольку напоминает состояние, характерное для относительного дефицита эстрогена, т. е. с характерными признаками остеопороза, ранней менопаузой и более низкими показателями рака эндометрия [5]. Однако данные, которыми мы располагаем сегодня, достаточно противоречивы, и только некоторые исследователи отмечают среди курильщиц уменьшение риска на 30–50% [1, 16].
Аналогии между опухолями гладкой мускулатуры и атеросклеротическими бляшками и, следовательно, возможную корреляцию между атерогенными факторами и риском миомы матки изучали Faerstein et al. Исследователи зафиксировали увеличение риска миом в 2,1 раза у пациенток до 35 лет с артериальной гипертензией, принимающих гипотензивную терапию дольше пяти лет и при длительности заболевания не менее пяти лет.
Таким образом, дальнейшие исследования, особенно посвященные цитогенетическим и молекулярным аспектам миом, приведут нас к определению тех генетических локусов, которые играют важную роль в индуцировании данных опухолей.
Патоморфология. Патогенез
Лейомиома матки представляет собой доброкачественную опухоль моноклонального происхождения, развивающуюся из гладкомышечных клеток и содержащую различное количество волокнистой соединительной ткани. Большинство ученых считают, что миома матки соответствует критериям истинной опухоли, о чем свидетельствуют: моноклональный характер развития миомы (как и большинство опухолей, в том числе и злокачественных), большие размеры и автономный рост опухоли, обусловленный воздействием факторов роста и цитокинов, активизация процесса неоангиогенеза, генетическая нестабильность (до 40% миом имеют генетические нарушения), т. е. вследствие мутаций уменьшается точность воспроизведения генетического аппарата, нарушается механизм репарации ДНК, изменяется регуляция клеточного цикла в поврежденных клетках, что приводит к неуклонной опухолевой прогрессии [1, 4, 25].
По мнению большинства ученых, миомы возникают в результате множественных соматических мутаций в нормальных клетках миометрия, что ведет к постепенному снижению регуляции их роста. Опухоль растет из клетки-прародительницы, в которой произошла первоначальная мутация и является следствием нарушения тканевого гомеостаза, поддерживаемого балансом клеточной пролиферации и апоптоза. В последнее десятилетие установлено, что образование и рост опухоли связаны с изменениями сложных взаимодействий между стероидными гормонами и их рецепторами, местными факторами роста и состоянием внеклеточного матрикса [20, 25, 12].
В настоящее время наибольшее подтверждение находит теория Fujii S., согласно которой развитие гладкомышечных клеток мезодермального происхождения происходит на эмбриональном этапе длительно: от 14 до 30 недель внутриутробного периода развития. Поэтому эти еще недифференцированные клетки за счет длительного периода внутриутробного развития могут подвергаться воздействию многочисленных факторов из организма матери (тропных гормонов, половых стероидов, факторов роста) и окружающей среды. Эти клетки-предшественники (уже с соматическими мутациями) сохраняются в миометрии и начинают расти после менархе. Их рост продолжается в течение многих лет на фоне выраженной активности яичников под действием как эстрогенов, так и прогестерона [12, 20, 27].
Также возможен и другой путь образования клеток-предшественников, при котором неопластическая трансформация миометрия может происходить в результате соматических мутаций нормального миометрия под влиянием половых стероидов и факторов роста. Однако молекулярные изменения, инициирующие эту трансформацию, до конца неизвестны.
Этиология и патофизиология остаются малопонятными, хотя к настоящему времени и определены основные молекулярно-генетические детерминанты возникновения этого заболевания. К ним относятся цитогенетические нарушения, изменения половых стероидов и гормональной чувствительности тканей, нарушение процесса ангиогенеза. В ткани миоматозных узлов в 40–50% имеются опухоль-специфические дефекты хромосом, определяемые кариотипически, что подтверждает роль генетических механизмов в росте и развитии миомы матки. Согласно современным представлениям, рост миомы происходит главным образом за счет пролиферации, стимулированной половыми стероидами через факторы роста по аутокринно-паракринному механизму, при относительно низкой готовности опухолевых клеток к апоптозу.
Несомненно, миома матки является гормонозависимой опухолью. До настоящего времени не известны механизмы, запускающие рост опухоли, но несомненна центральная роль половых стероидов — эстрогенов, прогестерона и их рецепторов в моделировании роста, дифференцировки и функции миометрия. Известно, что ключевую роль в контроле роста и развития миоматозных узлов играют эстрогены. Подтверждением этому служит повышенный уровень экспрессии эстрогеновых рецепторов в ткани узлов, по сравнению с неизмененным миометрием [8], а также стимулирующий эффект эстрогенов на синтез ДНК и клеточную пролиферацию в тканях матки. Также имеются данные о повышении уровня антигена клеточной пролиферации Ki-67 в нормальном миометрии [11] и усиление роста миомы матки преимущественно в лютеиновую фазу [20], что подтверждает роль прогестерона в индуцировании митогенного эффекта факторов роста. Очевидно, влияние эстрогенов и прогестерона комплементарны, т. е. эстроген создает условия для стимуляции пролиферации прогестероном [13]. Это подтверждается и работами, в которых прогестерон вызывает увеличение экспресии PCNA и эпидермального фактора роста в клетках миомы, тогда как эстрадиол в тех же клетках увеличивает экспрессии PCNA и ЭФР-рецептора [25, 11]. Следовательно, сочетанное действие эстрадиола и прогестерона стимулирует пролиферативный потенциал клеток миомы.
Другим потенциальным механизмом образования миомы матки является торможение механизмов апоптоза [12, 17]. В многочисленных работах доказано влияние половых стероидов не только на пролиферативные процессы, но и на регуляцию апоптоза в миометрии. Установлено, что протеин Bcl-2, тормозящий апоптоз, значительно меньше экспрессируется при лейомиоме по сравнению с нормальным миометрием. Причем эстрадиол, подавляя экспрессию этого протеина, снижает апоптоз.
Таким образом, развитие пролиферативных процессов, к которым относится и лейомиома матки, обусловлено не только повышенной пролиферацией клеток, но, возможно, и ослаблением индукции апоптоза.
В реализации влияния половых стероидов участвуют местные ауто- и паракринные факторы (факторы роста, цитокины и др.), продукция которых находится под контролем эстрогенов и прогестерона. Митогенное действие эстрогенов опосредовано местными регулирующими ростовыми факторами. Результатом их избыточной продукции является ускорение клеточной пролиферации, гипертрофия клеток, увеличение объема межклеточного матрикса, и нередко отмечается сочетание этих явлении [8]. Наиболее значимыми факторами роста для миомы являются трансформирующий фактор роста-бета (ТФР-бета), стимулирующее влияние на продукцию которого оказывает также и прогестерон. Эстрогены действуют и на межклеточный матрикс, оказывая непосредственное стимулирующее влияние на коллаген типа I и III и протеин коннексин-43 щелевидных межклеточных контактов [14].
Таким образом, стероидные гормоны могут оказывать стимулирующее влияние на пролиферацию опухолевой ткани путем воздействия и на местные факторы роста, продуцируемые гладкомышечными клетками и фибробластами [14, 25]. Влияние медиаторов различных факторов клеточного роста, также как и половых стероидов, осуществляется через клеточные рецепторы, концентрация и чувствительность которых играют важную роль в регуляции опухолевого роста. Основными модуляторами клеточного роста, обладающими выраженными митогенными свойствами на миометрий и ткань миомы, являются ИПФР-1, эпидермальный фактор роста (ЭФР), ТФР-бета и группа ангиогенных факторов роста. В настоящее время ангиогенез рассматривается как ключевой фактор в развитии опухолевых процессов. Это касается и роли ангиогенеза в патогенезе миомы матки. Основными индукторами процесса ангиогенеза являются сосудистый эндотелиальный фактор роста (СЭФР-А), ангиогенин и основной фактор роста фибробластов (ФРФ-2).
Противоположным действием на ангиогенез и, следовательно, ограничивающим рост опухолевой ткани обладают ингибиторы ангиогенеза. Одним из основных является эндостатин, который является не только мощным ингибитором ангиогенеза, но и специфическим ингибитором пролиферации клеток эндотелия. СЭФР — является важнейшим фактором, определяющим процессы образования новых сосудов и повышенную сосудистую проницаемость. Гипоксия ткани внутри миоматозного узла стимулирует экспрессию СЭФР и, таким образом, вызывает отек узла, что обусловлено способностью СЭФР повышать проницаемость сосудов [38]. Экспрессия СЭФР в тканях матки и яичников может регулироваться гормональным путем — половыми стероидами. Следует отметить, что ТФР-бета и ФРФ могут являться и факторами, модулирующими рост сосудов; ФРФ являются потенциальными митогенами, в то время как ТФР-бета — выраженный ингибитор пролиферации клеток эндотелия. Полагают, что ФРФ стимулируют ангиогенез, непосредственно воздействуя на эндотелиальные клетки, в то время как ТФР-бета оказывает опосредованное непрямое влияние, стимулируя другие клеточные типы к выделению факторов, стимулирующих клетки эндотелия.
Процессы ангиогенеза в миомах неразрывно связаны с морфогенезом этих опухолей и в значительной степени определяют особенности возникновения, характер роста и клинико-морфологические варианты (простая и пролиферирующая миома матки), и, по мнению ряда авторов, методы лечения миомы матки в перспективе должны быть связаны с возможностью воздействия на процессы ангиогенеза [6, 14].
Следовательно, половые стероиды осуществляют регуляцию роста миомы посредством комплекса факторов, регулирующих пролиферацию, апоптоз и ангиогенез в опухолевой ткани.
Таким образом, многочисленные исследования, посвященные патогенезу данного заболевания, выявили ряд факторов роста и рецепторов, влияющих на пролиферацию гладкомышечных клеток, апоптоз, продукцию межклеточного вещества, на пролиферацию и миграцию эндотелиоцитов, играющих важную роль в процессе развития опухоли. Полученные научные данные внесли не только определенную ясность в понимание механизмов влияния половых стероидов на рост миомы матки, но наметили новые направления в медикаментозном лечении.
Диагностика. Клиника
Основными инструментальными методами диагностики миомы матки являются ультразвуковое исследование (УЗИ), значительно реже — компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). В последние два десятилетия гистероскопия и лапароскопия обеспечили новый метод диагностики и лечения миомы матки. Информативным методом распознавания субмукозной и интерстициальной с центропетальным ростом миомы матки является гистероскопия (точность достигает 99,2%). Достоинство метода — возможность одновременной биопсии эндометрия, с целью диагностики сопутствующих гиперпластических процессов. Лапароскопия используется преимущественно при необходимости дифференциальной диагностики миомы и опухоли яичника, а также для распознавания вторичных изменений в миоматозных узлах, являющихся противопоказанием к консервативной терапии.
У половины пациентов болезнь протекает бессимптомно и диагностируется только при гинекологическом или ультразвуковом исследовании. Но у каждой второй женщины возникают симптомы заболевания, которые ухудшают качество жизни и требуют лечения. Симптомы зависят от количества, размеров и расположения миоматозных узлов, а также от степени вторичных дегенеративных и воспалительных изменений в ткани узлов. Основные симптомы лейомиомы матки: 1) обильные, длительные менструации и/или ациклические кровотечения, которые сопровождаются слабостью, утомляемостью, приводят к развитию железодефицитной анемии, 2) тянущие боли внизу живота (у 20–30% больных), очень редко возникают острые боли, связанные с нарушением кровотока в миоматозных узлах, и сопровождаются повышением температуры, слабостью, 3) при больших размерах лейомиомы матки может происходить давление на соседние органы: мочевой пузырь, прямую кишку, что проявляется учащенным мочеиспусканием, запорами, 4) бесплодие, невынашивание беременности, осложнения во время родов наблюдаются у каждой третьей пациентки с множественными миомами.
Тактика ведения
Несмотря на то, что миома матки является наиболее часто выявляемым заболеванием, в тактике ведения больных данной патологией остается много нерешенных вопросов и противоречий. В разных странах имеются различные подходы к лечению заболевания, отличаются и показания к радикальным операциям. Тактика ведения больных миомой матки включает три основных направления: выжидательное, консервативное и активное воздействие на опухоль.
Выжидательное ведение больных с миомой матки возможно только при отсутствии симптоматики и небольших по размеру (до 10–12 недель) опухолях при реализованной репродуктивной функции и заключается в активном амбулаторном наблюдении: динамическое ультразвуковое исследование, цитологический контроль состояния эпителия шейки матки и эндометрия, определение уровня онкомаркеров. Однако, учитывая частоту встречаемости сопутствующей патологии при миоме матки, только у небольшого числа пациентов мы можем ограничиться выжидательной тактикой ведения.
Консервативное ведение больных миомой матки заключается преимущественно в гормональном лечении, хотя в последние годы предложены противофибротические средства, антиангиогенные, аналоги соматостатина (в настоящий момент эти препараты находятся на стадии клинических испытаний). Среди гормональных препаратов несомненное лидерство принадлежит аналогам гонадолиберина и антигестагенному препарату — мифепристону (RU 486). Эти препараты используются как в качестве самостоятельного лечения, показания к которому четко определены, так и в качестве адъювантной терапии, имеющей определенные преимущества и недостатки.
Активная тактика ведения больных с миомой матки делится на два основных направления: хирургическое лечение и малоинвазивные вмешательства. Хирургический метод продолжает оставаться основным методом лечения данной категории больных — до 80% больных подвергаются гистерэктомии или миомэктомии. Однако многие женщины в наше время стремятся отложить деторождение на более поздний возраст, когда, к сожалению, значительно чаще развивается лейомиома матки. Поэтому совершенствование медикаментозного лечения и малоинвазивных, органосохраняющих технологий является основной тенденцией в современных условиях.
Методы лечения
Поиск и применение новых лекарственных средств и малоинвазивных технологий, приближающихся по эффективности к гистерэктомии и не вызывающих побочных эффектов, является альтернативным лечением миомы матки.
В настоящее время можно выделить три основных подхода к лечению миомы матки.
Традиционно терапевтическое лечение миомы матки основывается на воспроизведении медикаментозной псевдоменопаузы и/или индукции гипоэстрогении. Медикаментозная терапия в качестве монотерапии, как правило, назначается пациенткам при бессимптомном течении заболевания и при небольших (соответствующих менее 12 нед беременности) размерах опухоли [1, 15, 16). На протяжении довольно длительного времени использовались гестагены: норэтистерон (Норколут, Примолют-нор), дидрогестерон (Дюфастон) и др. Однако результаты лечения были малоэффективны. Основываясь на прогестероновой гипотезе развития миомы матки, малоэффективные результаты лечения производными прогестерона вполне объяснимы. В настоящее время применение гестагенов оправдано только при сочетании миомы матки (небольших размеров) с гиперпластическими процессами эндометрия и аденомиозом у женщин позднего репродуктивного или пременопаузального периода при постоянном динамическом наблюдении. Современное медикаментозное лечение включает применение агонистов гонадотропин-релизинг гормона (аГн-РГ) либо в качестве долгосрочной монотерапии, либо как этап комбинированного метода [15, 16].
Однако при несомненной эффективности этих препаратов, даже при минимальном курсе лечения (3–4 месяца), они обладают выраженным побочным действием, связанным с развитием эстроген-дефицитного состояния. Механизм действия этих препаратов заключается в подавления гонадотропной функции гипофиза, вследствие которой развивается гипоэстрогения и блокада продукции прогестерона. Очевидно, агонисты гонадолиберина действуют непосредственно и на опухолевую ткань, что подтверждается наличием рецепторов к гонадолиберину, снижением уровня рецепторов к эпидермальному фактору роста, подавлением продукции ТФР-бета и пролактина непосредственно в ткани лейомиомы матки (при лечении этими препаратами). Возможна также непосредственная стимуляция аналогами гонадолиберина процессов апоптоза в опухолевой ткани, что подтверждается повышением экспрессии рецепторов Fas и их лигандов (маркеры апоптоза). Десенситизация гипофиза и подавление функции яичников приводят к уменьшению объема матки и лейомиомы примерно на 50–65% и прекращению меноррагий, благодаря развитию аменореи, что позволяет скорректировать анемию до операции. Оптимальным режимом введения данных препаратов является короткий 3–4-месячный курс с ежемесячными инъекциями. Важной особенностью действия аГн-РГ является снижение кровоснабжения узлов, что стимулирует процесс апоптоза, а также уменьшает кровопотерю и сокращает длительность оперативного вмешательства. Побочные эффекты аГн-РГ связаны с гипоэстрогенией, проявляющейся вазомоторными симптомами, снижением минеральной плотности костной ткани, что ограничивает длительность приема и требует корригирующей терапии.
Принципиально новым препаратом, применяемым при лечении больных с миомой матки, является антипрогестин — мифепристон. Мифепристон — это синтетический стероид, обладающий одновременно антипрогестероновой и антиглюкокортикоидной активностью. Механизм действия заключается в связывании с прогестероновыми рецепторами, вследствие чего блокируется их функция. Суточная доза препарата — 50 мг в течение трех месяцев перорально, непрерывно. Эффективность препарата сравнима с эффективностью аналогов гонадолиберина — на 40–49% уменьшаются размеры матки и узлов. Основная особенность действия этого препарата — отсутствие гипоэстрогении, поэтому не наблюдается ни вазомоторных симптомов, ни снижения минеральной плотности костной ткани. У большинства женщин с миомой матки развивается аменорея при 3-месячном и более длительном курсе лечения. Первоначально мифепристон у больных с миомой матки применялся в качестве предоперационной подготовки, что являлось вполне обоснованным, так как при минимальных побочных эффектах (слабые приливы, тошнота) удается добиться снижения размеров опухоли и уменьшения менометроррагий. В настоящее время проводятся научные исследования по применению этого препарата и в качестве единственного метода лечебного воздействия в более длительном режиме [10, 22, 23].
Недавно предложены совершенно новые подходы к лечению миомы матки — блокирование действия специфических факторов роста [16, 28]. Действие одной группы препаратов (так называемая антифибротическая терапия) основывается на том, что лейомиомы содержат большое количество внеклеточного матрикса, состоящего из фибронектина, коллагена типа 1, 3 и протеогликанов. Доказано, что ТФР-бета и ФРФ увеличивают продукцию межклеточного вещества гладкомышечными клетками и снижают образование коллагеназы. Пирфенидон — антифиброзный препарат, ингибирует синтез ДНК, клеточную пролиферацию и продукцию коллагена в гладкомышечных клетках лейомиомы и нормального миометрия, вызванную вышеназванными факторами роста. Этот препарат обладает дозозависимым действием, минимальным количеством побочных эффектов и не оказывают токсического воздействия на гладкомышечные клетки. (В настоящее время проводятся клинические испытания.)
Действие другой группы препаратов основывается на ингибировании ангиогенеза [6, 14, 16]. Несколько факторов роста принимают участие в процессе ангиогенеза: ФРФ, ТФР, СЭФР (последний является важнейшим, так как синтезируется большинством линий опухолевых клеток и обладает многосторонним влиянием). Двумя основными механизмами эти факторы роста индуцируют рост лейомиомы матки: первый — усиление пролиферации, миграции гладкомышечных клеток сосудов и эндотелиоцитов; второй — стимуляция формирования кровеносных сосудов. Пока только единственный препарат, обладающий ингибирующим влиянием на ангиогенез, — интерферон-альфа прошел клиническое испытание на 20 больных с лейомиомой матки. Показано достоверное уменьшение объема образования уже после первой недели лечения. Таким образом, ингибирование ангиогенеза, посредством воздействия на перечисленные факторы роста, представляет собой одну из наиболее перспективных стратегий лечения лейомиомы матки.
Следовательно, для большинства пациентов более привлекательным остается медикаментозное лечение в качестве единственного метода. Поэтому поиск новых лекарственных средств, позволяющих избежать оперативное вмешательство и в то же время не приводящих к выраженным побочным эффектам, поможет решить важную проблему женского здоровья.
Другим направлением в органосберегающих методах лечения миомы матки, которые бы при высокой эффективности обладали и максимальной (достаточной) безопасностью, стала разработка в конце 90-х годов нового неинвазивного хирургического метода, который получил название «Неинвазивная абляция миомы матки воздействием фокусированного ультразвука (ФУЗ) под контролем ядерно-магнитно-резонансной томографии».
Об эффективности и безопасности ФУЗ-МРТ-абляции сообщали C. M. Tempany и соавт. (2000), Rabinovici J. и соавт. (2002), а Jolesz F. A., Hynynen K. (2002) назвали метод ФУЗ «идеальной операцией». Технология ФУЗ-МРТ представляет собой сочетание высокоинтенсивного фокусированного ультразвука, луч которого неинвазивно нагревает выбранные участки ткани миомы и вызывает их термический некроз, и магнитно-резонансной томографии. Звуковые волны проходят сквозь ткани, не вызывая их повреждения, и за счет фокусировки волн происходит локальный нагрев ткани миомы до 55–90 °С, что вызывает термическую коагуляцию в четко ограниченной области, не оказывая никакого вредного воздействия на окружающие ткани, т. е. ФУЗ-МРТ-абляция обеспечивает локальный селективный коагуляционный некроз в малом объеме ткани (в точке фокуса), что используется для прецизионной неинвазивной абляции опухолей.
Процесс лечения состоит в последовательных воздействиях (так называемых соникаций) на небольшие фрагменты опухоли, что приводит к нагреванию их и селективному коагуляционному некрозу. Механизм действия ФУЗ-абляции включает как прямое, так и опосредованное повреждающее воздействие. Прямое — это термическое воздействие за счет высвобождения энергии звуковой волны. Опосредованное — за счет изменения локального кровотока и нарушения питания опухолевой ткани. Доказано, что при нагревании ткани до 60 °С в течение 1 секунды происходит гибель всех клеток за счет их дегидратации, повреждения сосудистых структур, денатурации белков и разрушения коллагеновых волокон. Иммуногистохимические исследования показали, что данный метод вызывает летальное или сублетальное повреждение опухолевой ткани и исчезновение ее пролиферативной активности, при этом избирательность воздействия и полная безопасность ФУЗ для интактных тканей, окружающих миому, обусловлены также разницей в перфузии крови в миоматозном узле по сравнению с нормальным миометрием и преимущественным расположением сосудов по периферии узла миомы.
ФУЗ-МРТ-абляция особенно эффективна для лечения миомы матки вследствие высокого содержания экстрацеллюлярного матрикса, хорошо поглощающего тепло. Для доброкачественной опухоли нет необходимости элиминации каждой ее клетки, поэтому достаточно произвести коагуляцию в отдельных точках внутри миомы, что позволяет сократить объем миоматозных узлов и матки и тем самым уменьшить меноррагии, боли и давление на соседние органы малого таза, значительно улучшить качество жизни.
Продолжительность процедуры ФУЗ-абляции зависит от объема и количества узлов и в среднем составляет 3–4 часа. Эта процедура проводится амбулаторно, без общей анестезии, во время нее пациентка находится в сознании. После лечения пациентки обычно наблюдаются в стационаре в течение двух часов, что обусловлено только периодом действия седативных препаратов премедикации, и на следующий день уже трудоспособны.
Показаниями к ФУЗ-МРТ-абляции миомы матки являются: меноррагии, болевой синдром, симптомы сдавления соседних органов, размеры миоматозных узлов от 2 до 15 см, интерстициально-субсерозные, интерстициальные и интерстициально-субмукозные узлы, при количестве миоматозных узлов не более 5.
Противопоказаниями для ФУЗ-МРТ-абляции миомы следующие: субсерозные миомы на ножке, сочетанная гинекологическая патология — воспалительные процессы в малом тазу, бесплодие, образования в яичниках, гиперплазия эндометрия; онкологические заболевания, нереализованная репродуктивная функция, размеры миоматозных узлов менее 2 см, выраженное retroflexio-versio матки, грубые послеоперационные рубцы на передней брюшной стенке, ожирение II–III степени, тяжелые аллергические реакции на контрастные вещества, а также клаустрофобия, наличие крупных ферромагнитных имплантантов, наличие искусственных водителей ритма сердца (противопоказания для проведения МРТ).
Индивидуализация применения ФУЗ-МРТ-абляции миомы матки заключается в определении «доступности» миоматозных узлов для фокусированного ультразвука (предпочтительна локализация узлов по передней стенке и в дне матки), определении МРТ-типов миомы, необходимости проведения дополнительных манипуляций (висцеральный массаж, наполнение мочевого пузыря физиологическим раствором и т. д.), при этом интраоперационная эффективность ФУЗ-МРТ-абляции миомы снижается.
Обычно проводится либо «малая» процедура, при которой абляции подвергается около 30–35% объема миоматозного узла, либо «большая» — коагулируется не менее 70% объема. После «малой» процедуры не происходит значительного уменьшения размеров опухоли, тем не менее в 80% случаев отмечается значительная положительная динамика, исчезновение жалоб, болей и прекращение кровотечений. Кроме того, снижается пролиферативная активность миомы, и рост узлов прекращается. Это объясняется уменьшением плотности ткани после ФУЗ-МРТ-абляции — узлы становятся более «мягкими» и не оказывают выраженного давления на окружающие ткани. В настоящее время проводится лечение миом матки диаметром до 9 см, а в случае большого размера миомы — предварительная гормональная терапия в течение трех месяцев, с целью сокращения узлов и возможности проведения процедуры. Группой исследователей из США изучена безопасность и эффективность операций фокусированным ультразвуком под контролем МРТ для неинвазивного лечения лейомиомы матки [3, 24]. Согласно этим данным происходит уменьшение миомы через 3 мес на 37%, через 6 мес на 48% [19, 24]. За последние 2 года получено 30 беременностей у женщин, перенесших ФУЗ-МРТ-абляцию миомы матки и 13 родов без осложнений [26]. Среди осложнений ФУЗ-МРТ-абляции выделяют незначительную воспалительную реакцию (субфебрильная температура) и ожог I степени.
Таким образом, ФУЗ-МРТ-абляция имеет определенные преимущества по сравнению с малоинвазивными и инвазивными методами лечения:
Источник