- Образ жизни при болезни Шарко-Мари-Тута
- Что такое болезнь Шарко-Мари-Тута?
- Какие нагрузки следует избегать людям с болезнью Шарко-Мари-Тута?
- Какие виды спорта полезны при болезни Шарко-Мари-Тута?
- Что необходимо предпринять для профилактики деформаций стоп?
- Какой образ питания рекомендуется детям и взрослым, страдающим болезнью Шарко-Мари-Тута?
- Может ли прием лекарств негативно влиять на тяжесть заболевания?
- Одна болезнь, сто генов, миллионы людей: как вылечить болезнь Шарко—Мари—Тута
- Конкурс «Био/Мол/Текст»-2020/2021
- Клетки и их строение
- Клетки нервной системы
- Миелин
- Строение клеток
- Мутации, вызывающие БШМТ
- Немного истории
- Разбираемся в запутанном: классификация БШМТ
- Терапевтические подходы согласно самым распространенным типам
- Периферический миелиновый белок 22 (PMP22): дупликация — тип 1A, точечная мутация — тип 1Е
- Терапевтические подходы 1: боремся с последствиями
- Терапевтические подходы 2: искоренение проблемы
- Белок коннексин-32 (GJB1): тип 1Х
- Нулевой миелиновый белок (MPZ, P0): тип 1В и тип 3
- Митофузин-2 (MFN2): тип 2А
- БШМТ — заболевание ПНС и не затрагивает ЦНС. Так ли это?
- Поддерживающая терапия при БШМТ
- Мировые активности, посвященные БШМТ
- Заключение
Образ жизни при болезни Шарко-Мари-Тута
БОЛЕЗНЬЮ ШАРКО-МАРИ-ТУТА СТРАДАЮТ ОКОЛО 3-Х МИЛЛИОНОВ ЧЕЛОВЕК ВО ВСЕМ МИРЕ. В КРАСНОЯРСКЕ И КРАСНОЯРСКОМ ЭТО НАСЛЕДСТВЕННОЕ ЗАБОЛЕВАНИЕ ПЕРИФЕРИЧЕСКИХ НЕРВОВ ТОЖЕ ДОСТАТОЧНО РАСПРОСТРАНЕНО. В НАШЕМ РЕГИОНЕ ЕГО ВСТРЕЧАЕМОСТЬ ДОСТИГАЕТ 10 СЛУЧАЕВ НА 100 ТЫСЯЧ ЧЕЛОВЕК. ОБРАЗ ЖИЗНИ (ВЫБОР ФИЗИЧЕСКИХ НАГРУЗОК, СПОРТА, СТИЛЯ ПИТАНИЯ) И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ У НЕЙРОГЕНЕТИКА, ОРТОПЕДА И ПОДИАТРА МОЖЕТ СУЩЕСТВЕННО ЗАМЕДЛИТЬ ТЕМПЫ ПРОГРЕССИРОВАНИЯ ЗАБОЛЕВАНИЯ И УЛУЧШИТЬ КАЧЕСТВО ЖИЗНИ ПАЦИЕНТОВ.
Что такое болезнь Шарко-Мари-Тута?
Болезнь Шарко-Мари-Тута (синонимы: наследственная нейропатия Шарко-Мари-Тута, ШМТ, невральная амиотрофия) – наследственное заболевание периферической нервной системы, характеризующееся поражением чувствительных и двигательных нервов рук и ног.
Длинные волокна периферических нервов повреждаются сильнее, поэтому в первую очередь нарушаются функции наиболее удаленных (дистальных) отделов конечностей, испытывающих большую физическую нагрузку – это мышцы стоп и голеней. Мышцы кистей и предплечий обычно вовлекаются в патологический процесс в меньшей степени и на более поздних сроках развития заболевания.
Первые симптомы обычно появляются в возрасте 10-20 лет. Болезнь Шарко-Мари-Тута прогрессирует постепенно, исподволь:
- постепенно нарастает слабость в пораженных мышцах;
- становится заметным, что мышцы стоп и голеней уменьшились в объеме (атрофия мышц);
- изменяется форма конечностей: форма ног начинает напоминать вид «перевернутой бутылки шампанского» (так называемые «ноги аиста»);
- формируется сгибательная деформации стоп (сначала стопы могут приобретать высокий свод, затем формируется так называемая «полая стопа»);
- затрудняется ходьба: стоять и ходить на носках и/или пятках становится практически невозможно;
- позднее (чаще примерно через 10 лет после появления первых симптомов) в патологический процесс вовлекаются руки (кисти и предплечья): в них происходят те же изменения, что и в ногах, с формированием деформации по типу «когтистых лап»;
- иногда появляется неконтролируемая дрожь в пальцах кистей (постуральный или постурально-кинетический тремор);
- возможно искривление позвоночника (сколиоз или кифосколиоз) за счет вовлечения в атрофический процесс мышц туловища.
Какие нагрузки следует избегать людям с болезнью Шарко-Мари-Тута?
Детям и взрослым, страдающим наследственной нейропатией Шарко-Мари-Тута (синоним: болезнь Шарко-Мари-Тута), необходимо избегать чрезмерных физических и психических перегрузок, так как это может спровоцировать ухудшение состояния (нарастание слабости в мышцах рук и ног и нарушение чувствительности в конечностях).
Какие виды спорта полезны при болезни Шарко-Мари-Тута?
Дозированные физические нагрузки, такие как лечебная гимнастика, пилатес, катание на велосипеде и плавание, рекомендуются для профилактики развития контрактур суставов нарастания выраженности мышечных атрофий.
Пловцу Донне ДеУвик (Donna DeWick) в 2004 году был установлен диагноз наследственной нейропатии Шарко-Мари-Тута. Пережив тяжелое потрясение в связи с этим сообщением врачей, а также осознав, что в период с 2004 по 2007 годы состояние ее здоровья стало резко ухудшаться, она решила взять под контроль свое здоровье и благополучие, сохранить свою мобильность. Со временем она использовала спорт не только как транспортное средство по сбору средств благотворительности, но и как способ поверить в свои силы. Недавно она участвовала в 7000-метровом заплыве через Большой Чесакпикский залив.
«Независимо от результата, я действительно сделала все возможное, чтобы дать себе наилучший шанс для успеха в этот день», — сказала корреспондентам Донна.
В выборе спортивных нагрузок и спортивной диеты при болезни Шарко-Мари-Тута важен междисциплинарный подход и помощь, как лечащего врача нейрогенетика, так и ортопеда – специалиста по ЛФК и спортивной медицине. Так подход с успехом реализован на базе Неврологического центра Университетской клиники, где детям и взрослым подбирается индивидуальная программа спортивных нагрузок в тренажерном зале, бассейне, а также в домашних условиях в зависимости от характера и степени тяжести заболевания, возраста пациента. Консультирование и сопровождение пациентов совместно с нейрогенетиками центра осуществляет специалист по ЛФК и спортивной медицине Сергей Валентинович Невзоров.
Что необходимо предпринять для профилактики деформаций стоп?
В качестве профилактики развития ранней деформации стоп, необходимо носить удобную, не стесняющую стопы, обувь. Соответствующая обувь является очень важным пунктом для людей, страдающих наследственной нейропатией Шарко-Мари-Тута, но часто они испытывают трудности при поиске подходящей им обуви из-за высокого подъема и специфической формы ноги («полая стопа») и пальцев ног («молоточкообразные пальцы»).
Пациентам также рекомендуется регулярно посещать специалиста по проблеме заболеваний стоп — подиатра, (от лат. слова, означающего ступня) прием которого организован на базе кабинета ‘Диабетической стопы’ Университетской клиники (прием ведет хирург-подиатор, к.м.н. Виктория Павловна Овчинникова). Это важно для предупреждения и своевременного лечения трофических дефектов мягких тканей стопы в местах максимальной травматизации за счет развития деформаций стоп.
Аномалии ходьбы могут быть исправлены путем использования разных типов подтяжек, которые называются AFOs (ankle-foot orthoses). Эти крепления помогают контролировать тыльное сгибание ноги и голени, нестабильность голеностопного сустава и, зачастую, обеспечивают лучшее чувство равновесия. Ортезы позволяют пациентам максимально долго оставаться физически активными, самостоятельно передвигаться, предотвращая падения и получение травм.
Ортезы для фиксации стопы в физиологическом положении используются при синдроме «свисающей стопы».
Екатерина Александровна Козулина, кандидат медицинских наук, нейрогенетик, ведущий специалист по наследственной нейромышечной патологии Неврологического центра Университетской клиники поможет подобрать ортезы в зависимости от индивидуальных особенностей детей, подростков и взрослых, страдающих наследственной нейропатией Шарко-Мари-Тута, а также от выраженности амиотрофий и типа локомоторных нарушений. Некоторые люди для стабильности походки нуждаются в костылях или трости, и менее 5% нуждаются в инвалидных креслах.
Какой образ питания рекомендуется детям и взрослым, страдающим болезнью Шарко-Мари-Тута?
Пациенты должны придерживаться хорошо сбалансированной диеты, чтобы избежать ожирения, которое может способствовать возникновению боли в пояснице и оказывает дополнительную нагрузку на ослабленные мышцы. Пища должна быть богата антиоксидантами (витамины Е, С, А, селен).
Источником витамина С служит растительная пища. Особенно богаты витамином С перец и черная смородина, укроп, петрушка, капуста, щавель, цитрусовые, земляника. Но чемпионом среди всех растений является шиповник — 1,2 г на 100 г сухих ягод. Ежесуточно следует получать 50 мг аскорбиновой кислоты, однако наиболее оптимальной (вне стрессовой ситуации) является доза 100-200 мг в сутки. При ШМТ суточная доза витамина С может быть увеличена до 2 г. По данным зарубежных исследований, ежедневное употребление аскорбиновой кислоты в дозе 1-3 г способствует снижению сверхэкспрессии патологического гена РМР22 и уменьшает фенотипические проявления заболевания [Passage E. et al., 2004].
Считается что, аскорбиновая кислота в суточной дозе 100 мг достаточна для насыщения клетки крови, 400 мг/сут — достаточна для насыщения плазмы. M. Fontes предложил использование больших доз аскорбиновой кислоты (до 3 г/сут), объясняя это тем, что только большие концентрации эффективны на уровне клетки при ШМТ.
Может ли прием лекарств негативно влиять на тяжесть заболевания?
Людям, страдающим наследственной нейропатией Шарко-Мари-Тута, необходимо избегать приема лекарственных препаратов, оказывающих токсическое действие на периферическую нервную систему, нарушающих функцию пораженных при ШМТ нервов [Weimer W. et al., 2006]. http://www.krasmedic.ru/article/?idc=50&ids=&ida=615
Авторы: Наталья Алексеевна Шнайдер, заведующая кафедрой медицинской генетики и клинической нейрофизиологии ИПО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого, руководитель Неврологического центра Университетской клиники, д.м.н., проф.;
Екатерина Александровна Козулина, к.м.н., невролог-нейрогенетики Неврологического центра Университетской клиники
Елена Владимировна Глущенко, к.м.н., ассистент кафедры, невролог-нейрогенетик
Источники: — Шнайдер Н.А., Глущенко Е.В., Кантимирова Е.А., Козулина Е.А. Наследственная нейропатия Шарко-Мари-Тута: Учебное пособие для последипломного образования врачей. – Красноярск: Издательство «Гротеск», 2010. – 105 с.
— Всё про гены http://vse-pro-geny.com/ru_home.html
— Блог Донны ДеУвик «Я ПЫТАЮСЬ, потому что я МОГУ ….» (I TRI because I CAN…) http://www.beatinglimitations.com/
-National CMT resource center http://help4cmt.com/factsheets/?t=exercise
©Авторские права защищены. При использовании материала ссылки на авторов, сайт Университетской клиники и КрасГМУ им. проф. В.Ф. Войно-Ясенецкого обязательны.
Источник
Одна болезнь, сто генов, миллионы людей: как вылечить болезнь Шарко—Мари—Тута
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Болезнь Шарко—Мари—Тута (БШМТ или ШМТ) — самое распространенное наследственное заболевание нервной системы, о котором никто не знает. БШМТ сложно диагностировать и на данный момент невозможно вылечить. Моя статья расскажет, что это за заболевание, поведает о разнообразии его типов и симптомов и сообщит о разрабатываемых подходах для его лечения: от малых молекул до генной терапии. Для меня эта тема особенно важна, т.к. я сама страдаю от БШМТ и использую любую возможность информирования о ней. Надеюсь, эта статья поможет БШМТ пациентам более глубоко разобраться в своём заболевании, врачам — распознавать его симптомы и диагностировать, а всем остальным просто будет любопытно узнать о нём.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
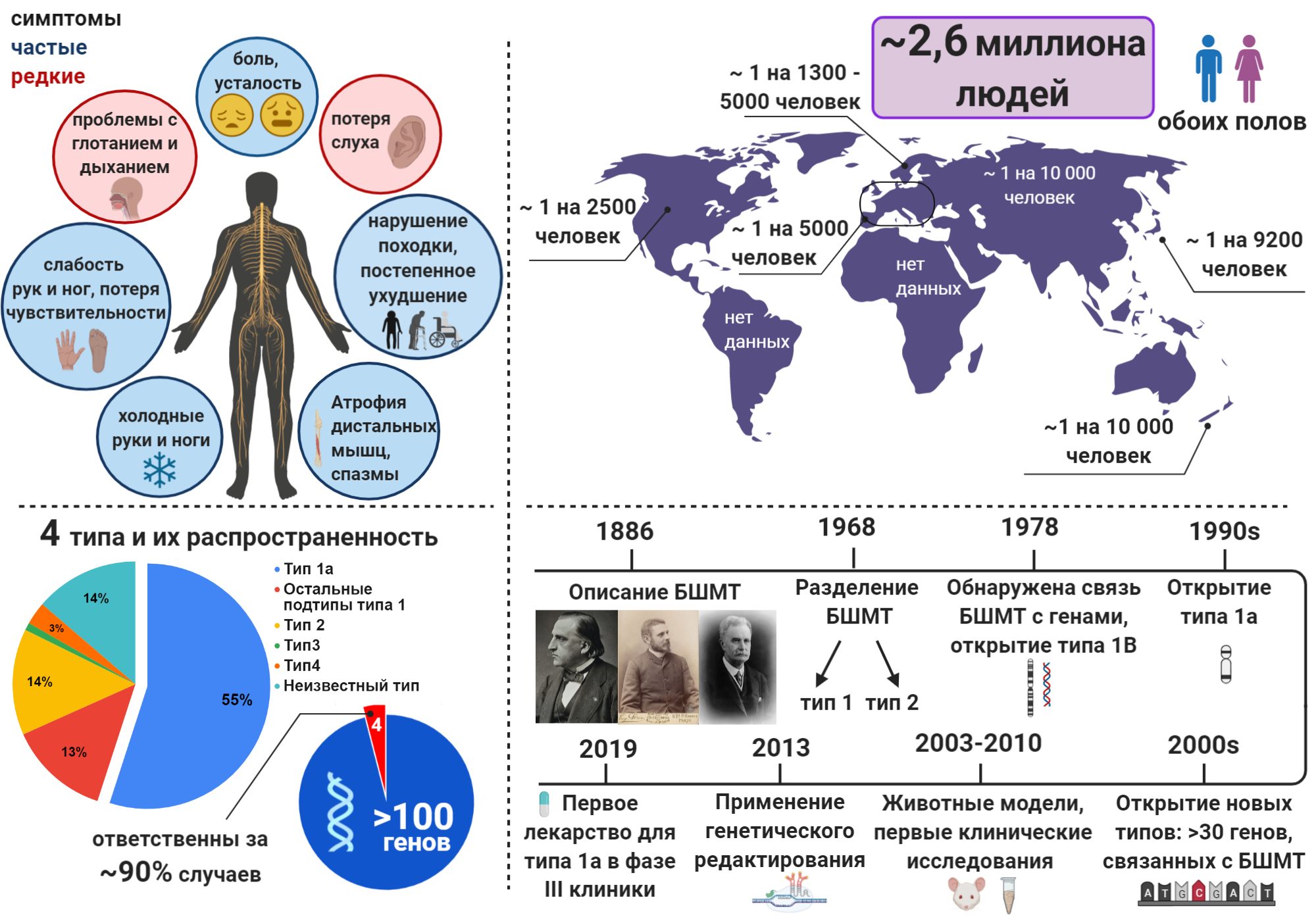
Удивительно, но, пожалуй, единственный верный способ узнать о болезни Шарко-Мари-Тута (БШМТ) на данный момент — получение такого диагноза после 3–10 лет скитаний по врачам [1]. Мне повезло, так как с момента возникновения симптомов до постановки диагноза прошло «всего» четыре года. В отличие от, например, рассеянного склероза [2], мало кто слышал о БШМТ. И это несмотря на то, что от последнего заболевания страдает бóльшее количество людей (2,6 миллионов [3] против 2,5 миллионов [4] людей во всем мире). О болезни Шарко-Мари-Тута нет новостных статей, практически невозможно найти информацию на русском о ее типах и разрабатываемых лекарствах. Такое удручающее состояние дел стало для меня мотивацией для запуска Инстаграм блога на русском языке, посвященного БШМТ, и написания этой статьи. В то же время БШМТ — самое часто встречаемое орфанное (редкое) заболевание, распространение которого варьируется в зависимости от методов оценки и которое ещё только предстоит выяснить во многих странах (рис. 1). БШМТ активно изучается, ведутся исследования по разработке терапий, в мире уже есть несколько ассоциаций, посвященных этой болезни, а в США даже специальные центры для пациентов с БШМТ.
Рисунок 1. БШМТ в числах
коллаж автора статьи. Создан с помощью BioRender.com
Сравнение БШМТ с рассеянным склерозом неслучайно: оба заболевания являются нейродегенеративными, прогрессирующими, часто проявляются неожиданно и в юношестве. Бóльшая часть случаев БШМТ представляет из себя демиелинизирующую форму. Это значит, что, как и в случае с рассеянным склерозом , страдает оболочка нейронов. Однако различия между ними существенны, самое важное из которых — очаг поражения: если при рассеянном склерозе страдает центральная нервная система (ЦНС), то при БШМТ — периферическая.
Для того, чтобы разобраться с БШМТ, нам необходима некоторая база, включающая анатомию нервной системы, строение клетки и немного генетики. С этого и начнем. (Читатели, знающие молекулярную и клеточную биологию, могут спокойно пропустить следующий раздел.)
Клетки и их строение
Клетки нервной системы
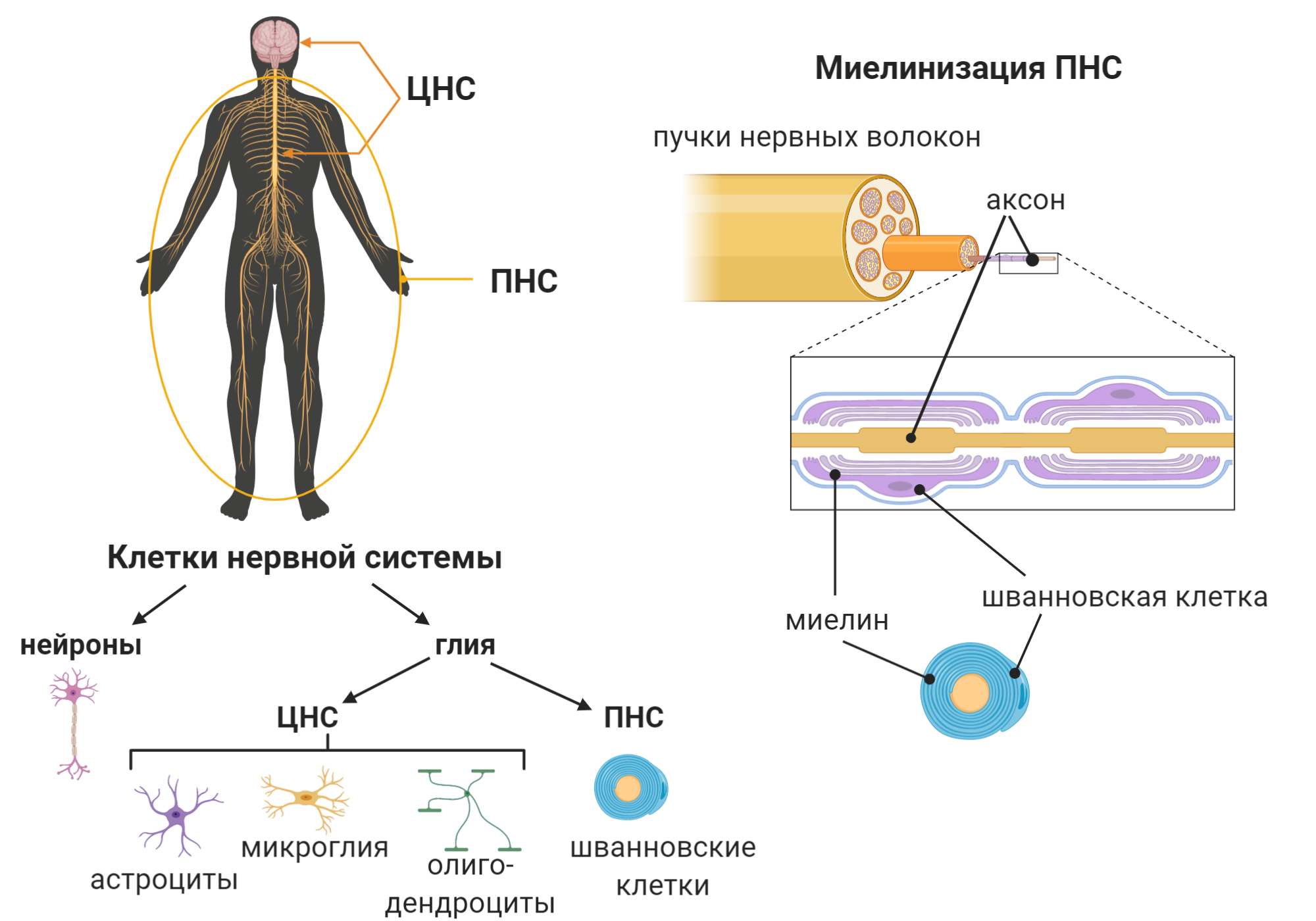
Периферическая нервная система (ПНС) необходима нам для управления телом и передачи информации извне для обработки в мозге. С помощью ПНС мы заставляем наши мышцы и суставы двигаться, а также контролировать внутренние органы и устанавливать контакты с внешним миром. ПНС — это совокупность всех нервных волокон минус головной и спинной мозг, которые составляют ЦНС (рис. 2).
Нервная система в целом состоит из двух типов клеток: нейронов и глии (или глиальных клеток). Первые известны своей электрической активностью и общением с помощью специальных молекул — нейротрансмиттеров. Вторые считаются вспомогательными клетками, которые выполняют обширный спектр функций: от предоставления энергии нейронам до производства специальной оболочки нейронов — миелиновой оболочки. За производство миелина отвечают специальные глиальные клетки: олигодендроциты в ЦНС и шванновские клетки в ПНС (рис. 2). Миелин оборачивает нервные волокна (длинные отростки нейронов — аксоны ) и выполняет роль изоляционного материала: по такому же принципу устроены кабели и провода. Такая структура обеспечивает быстрое прохождение сигнала по аксону (проводу) за счёт отсутствия проводимости тока через изоляцию (миелин). Повреждение же миелина приводит к нарушению скорости прохождения сигнала от нейронов к мышцам и от рецепторов к нейронам. В результате наблюдается атрофия мышц и потеря чувствительности — важные симптомы демиелинизирующей формы БШМТ.
Рисунок 2. Клетки нервной системы и её миелинизация
коллаж автора статьи. Создан с помощью BioRender.com
Миелин
C эволюционной точки зрения миелин — достаточно новое изобретение, возникшее у позвоночных как адаптивная мера. Миелин дал начало развитию сложных нервных систем с быстрой проводимостью электрического сигнала [5]. Отсюда можем сделать вывод, что разного рода повреждения миелина нарушают проводимость нервных импульсов и угнетают ряд функций организма. Что представляет из себя миелин? Это видоизмененная клеточная мембрана, оборачивающая аксон или пучки аксонов в виде спирали. В ПНС количество таких компактных слоев, оборачивающих один аксон, может достигать ста. В отличие от обычных клеточных мембран [6], миелин по большей части состоит из жиров (70–85%), а белки составляют лишь 15–30% миелина [7]. Подробнее о миелине можно почитать в статье «Обёртка для аксона» [8].
Состав и организация миелина ЦНС и ПНС несколько различаются, но нас интересует миелинизация ПНС, так как БШМТ затрагивает именно её. Так, шванновские клетки находятся в очень интимных отношениях с нейронами — они буквально обнимают аксоны своей миелиновой оболочкой, и — в отличие от олигодендроцитов — не распыляются на десятки нейронов, а уделяют внимание лишь одному или нескольким.
Строение клеток
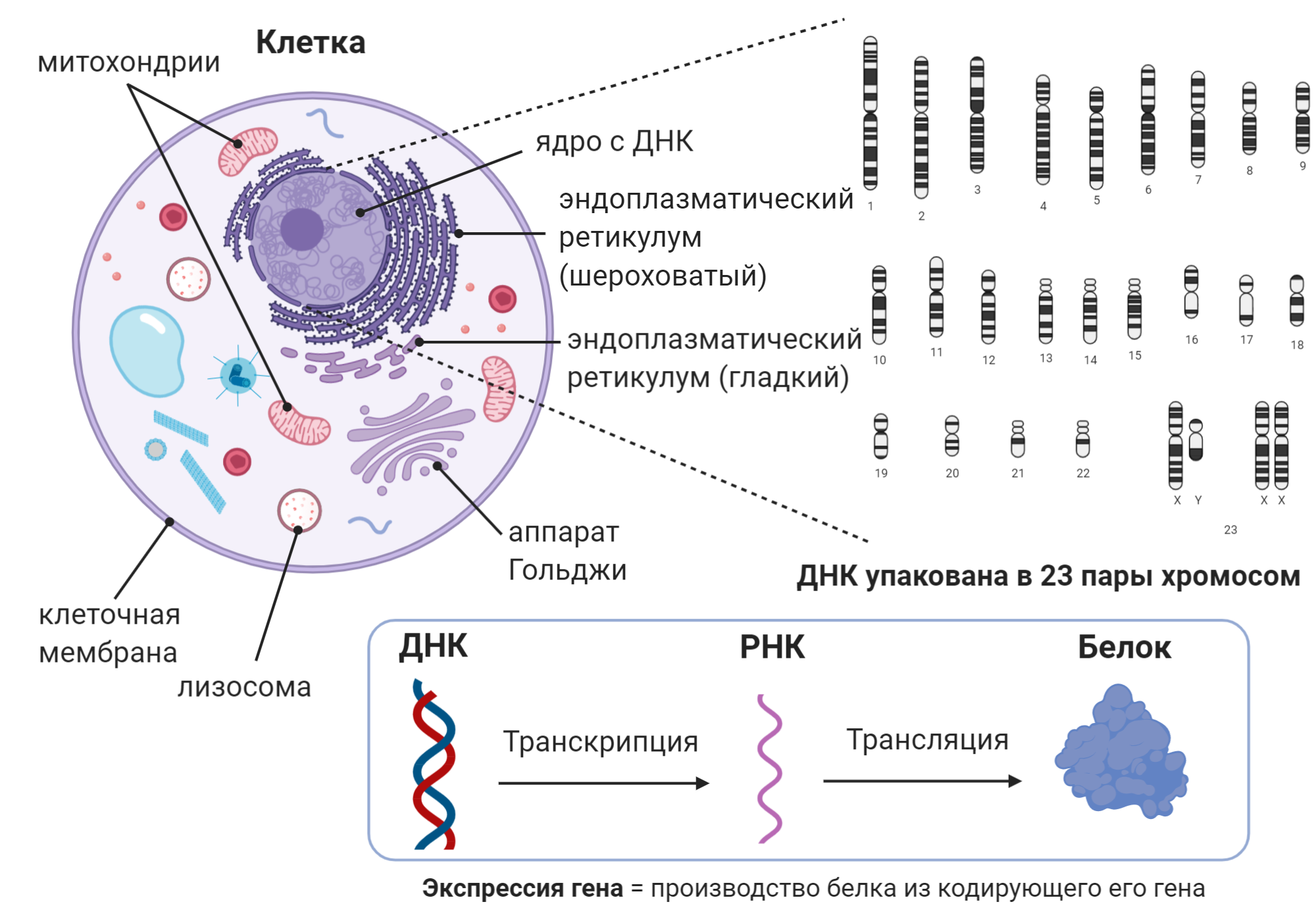
Помимо характерных черт нейронов и шванновских клеток нас также интересует общее строение клетки животных, а точнее её составляющие. В ядре клетки содержится генетическая информация в виде ДНК, которую удобно разделять на гены. На опредёленной стадии деления клетки ДНК упакована в хромосомы, которых у человека 23 пары: 22 аутосомные (неполовые) и 1 половая. Важным процессом является производство белков из ДНК через молекулу-посредник — РНК. Таким образом, гены являются инструкцией, в которой закодированы в том числе последовательности белков. Все эти три составляющие (ДНК — РНК — белок) можно воспринимать как набор букв, которые мы можем прочитать. Однако в контексте белков нас также интересует структура: они сворачиваются и образуют сложные трёхмерные молекулы — функциональные единицы клетки [9]. Помимо прочего, в эндоплазматическом ретикулуме происходит сворачивание белков, где они упаковываются в специальные шарики-везикулы и далее транспортируются к аппарату Гольджи. Здесь принимается решение о том, как белки будут использоваться: внутри клетки или за её пределами. Лизосомы необходимы для расщепления белков и других молекул — это клеточные инсинераторы (уничтожители), а митохондрии генерируют энергию и являются клеточными энергостанциями (рис. 3).
Рисунок 3. Строение клетки
коллаж автора статьи. Создан с помощью BioRender.com
Несмотря на то, что во всех клетках организма упакована одна и та же ДНК, по форме и функции клетки разных тканей и органов сильно отличаются. Более того, как мы уже упомянули, даже внутри нервной системы выделяют несколько типов клеток. Дело в том, что гены экспрессируются по-разному в разных клетках, то есть в каких-то клетках определённые гены активны, а в других — гены молчат. Таким образом, производство РНК и белков в клетках разных типов различается. В этом и есть фундаментальная причина, почему поломки (мутации) в каком-то гене приводят к заболеванию ПНС, а не, скажем, ЦНС: белок, который кодируется этим геном, не производится в ЦНС, соответственно и мутация «молчит». В случае с БШМТ заболевание вызвано мутациями в генах, экспрессируемых в шванновских клетках и/или нейронах. Разделение БШМТ на две формы, демиелинизирующую и аксональную, по-видимому, тоже связано с тем, в каких именно клетках экспрессируется белок, кодируемый поломанным геном. Демиелинизирующая форма обусловлена проблемами в генах, из которых будут произведены белки шванновских клеток (в частности, составляющие миелина). Аксональная же форма вызвана мутациями в генах, кодирующих белки нейронов. Однако не всё так просто.
Мутации, вызывающие БШМТ
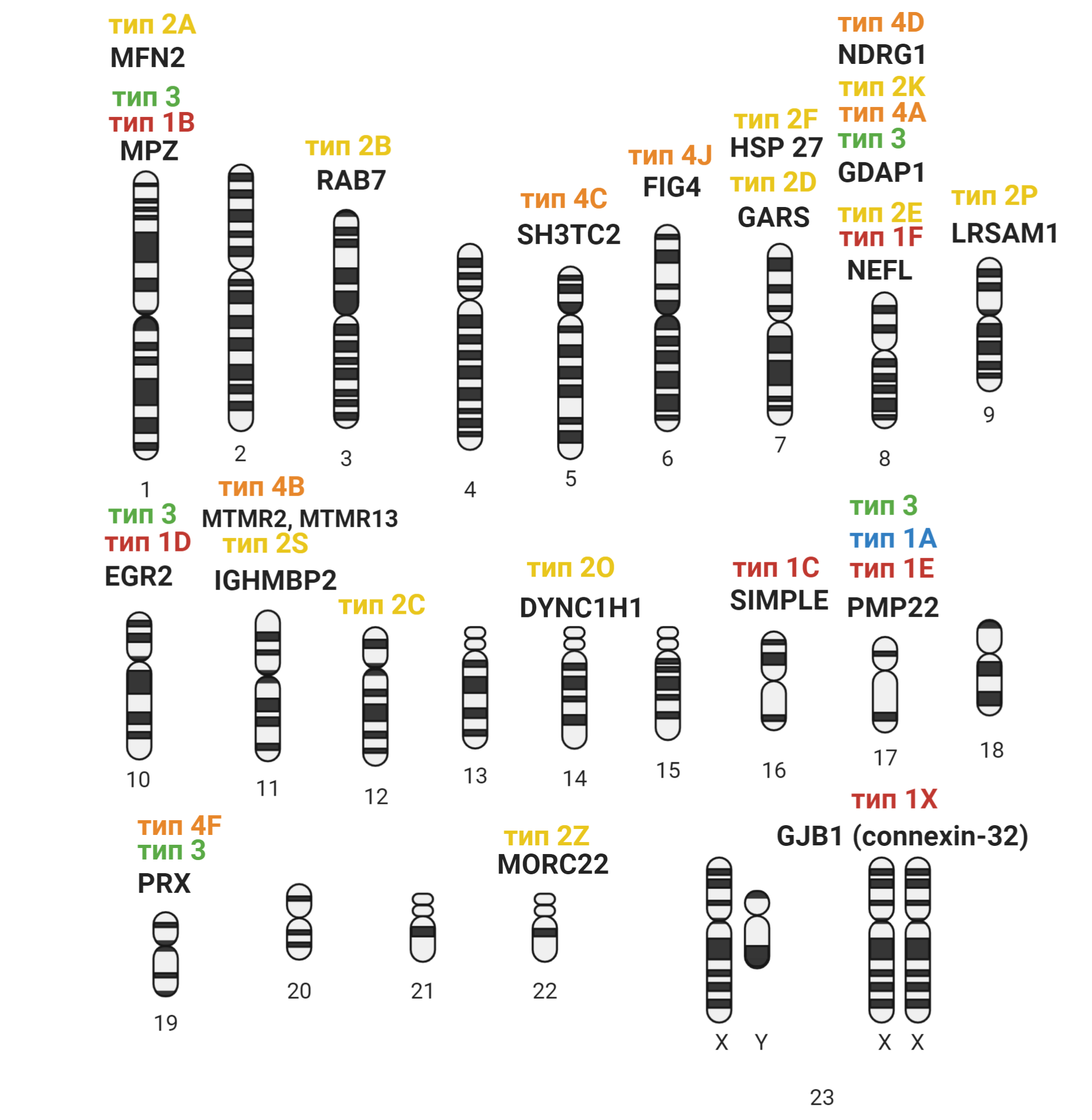
БШМТ — наследственное заболевание. Это значит, что причина возникновения заболевания — поломка генов. Таким образом, БШМТ — общее название для целого спектра наследственных заболеваний периферической нервной системы, вызванных мутациями в разных генах. На данный момент известно уже >100 генов, мутации в которых вызывают БШМТ 11, а недавно было описано еще 30 мутаций, потенциально вовлеченных в развитие заболевания [13]. БШМТ-ассоциированные гены разбросаны по разным хромосомам; мутации в них послужили основанием для классификации БШМТ на подтипы (рис. 4). Вместе с тем, мутации лишь в четырёх генах ответственны за >90% всех случаев заболевания 15. А 50–60% всех случаев БШМТ вызвано дупликацией (удвоением) части хромосомы 17, в которой находится ген PMP22 (этот тип известен как 1А) [16].
Рисунок 4. Подтипы БШМТ и гены, мутации в которых их вызывают, распределенные по разным хромосомам
коллаж автора статьи. Создан с помощью BioRender.com
Немного истории
Первые описания наследственного заболевания, при котором наблюдается прогрессирующая атрофия и слабость мышц конечностей, были задокументированы в середине 19 века Эйкхорстом [17]. Однако полноценное описание БШМТ появилось в 1886 году, когда невролог Шарко и его ученик Мари рапортовали о пяти случаях со следующими симптомами, появившимися у пациентов в возрасте от 3 до 15 лет: атрофия дистальных (дальних) мышц, полая стопа (с аномально высокой «аркой»), деформация пальцев рук и ног по типу «скручивания». Они считали, что повреждение спинного мозга — причина заболевания. В это же время физиолог Тут независимо описал пять случаев заболевания с теми же симптомами, указав на ПНС как возможную проблему. В итоге БШМТ получило свое название в честь этих трех нейрофизиологов (рис. 1).
Стоит заметить, что классификация наследственных невропатий, в частности БШМТ, никогда не отличалась простотой. Появились различные названия синдромов, схожих с БШМТ, в честь описавших их исследователей, что путает пациентов по сей день. Так, болезнь Дежерина-Сотта сейчас классифицируется как БШМТ тип 3, а термин «Руси-Леви » используется для описания определенного набора симптомов при БШМТ типа 1, в том числе тремор рук. Современная же классификация БШМТ была заложена Диком и Ламбертом в 1968 году, в которой были выделены две формы заболевания: тип 1, характеризующийся замедленной электрической проводимостью нервных волокон (демиелинизирующий тип), и тип 2, характеризующийся дегенерацией нейронов (аксональный тип). В 1980-х, наконец, была обнаружена связь БШМТ с генами, и был открыт тип 1B. А, когда стало ясно, что у большинства людей с БШМТ мутация не на хромосоме 1, а на хромосоме 17, был открыт тип 1А. В 1991 году было установлено, что изменение числа копий PMP22 — причина самого распространенного типа БШМТ (рис. 1).
Разбираемся в запутанном: классификация БШМТ
За последние 30 лет было открыто >100 генов, мутации в которых вызывают БШМТ. Классификация заболевания также изменилась. Помимо демиелинизирующей и аксональной формы, теперь выделяют ещё и промежуточную [18]. Для определения формы заболевания, как правило, используется электромиография (ЭМГ) — метод оценки скорости проводимости нервных волокон с помощью электродов. Результат такого исследования пациента записывается в виде кривой (электромиограмма) и расшифровывается врачом. Как уже было сказано, повреждение миелина ведёт к замедлению прохождения электрического импульса нейронов. Соответственно, снижение скорости импульса говорит о демиелинизирующем типе. Аксональный тип характеризуется сниженной амплитудой («силой») нервного импульса [19]. Промежуточный (смешанный) тип сочетает в себе снижение и скорости, и силы импульса, что, по всей видимости, обусловлено механизмом заболевания: мутации, приводящие к этой форме, затрагивают как нейроны, так и шванновские клетки [20]. Справедливее всего было бы все типы БШМТ назвать смешанными, так как в конечном счёте страдает как миелин, так и аксон. Различие лишь в том, что при аксональной форме аксон страдает в первую очередь, а при демиелинизирующей — во вторую. При этом именно дегенерацию аксона связывают с функциональными нарушениями у пациентов с БШМТ [21].
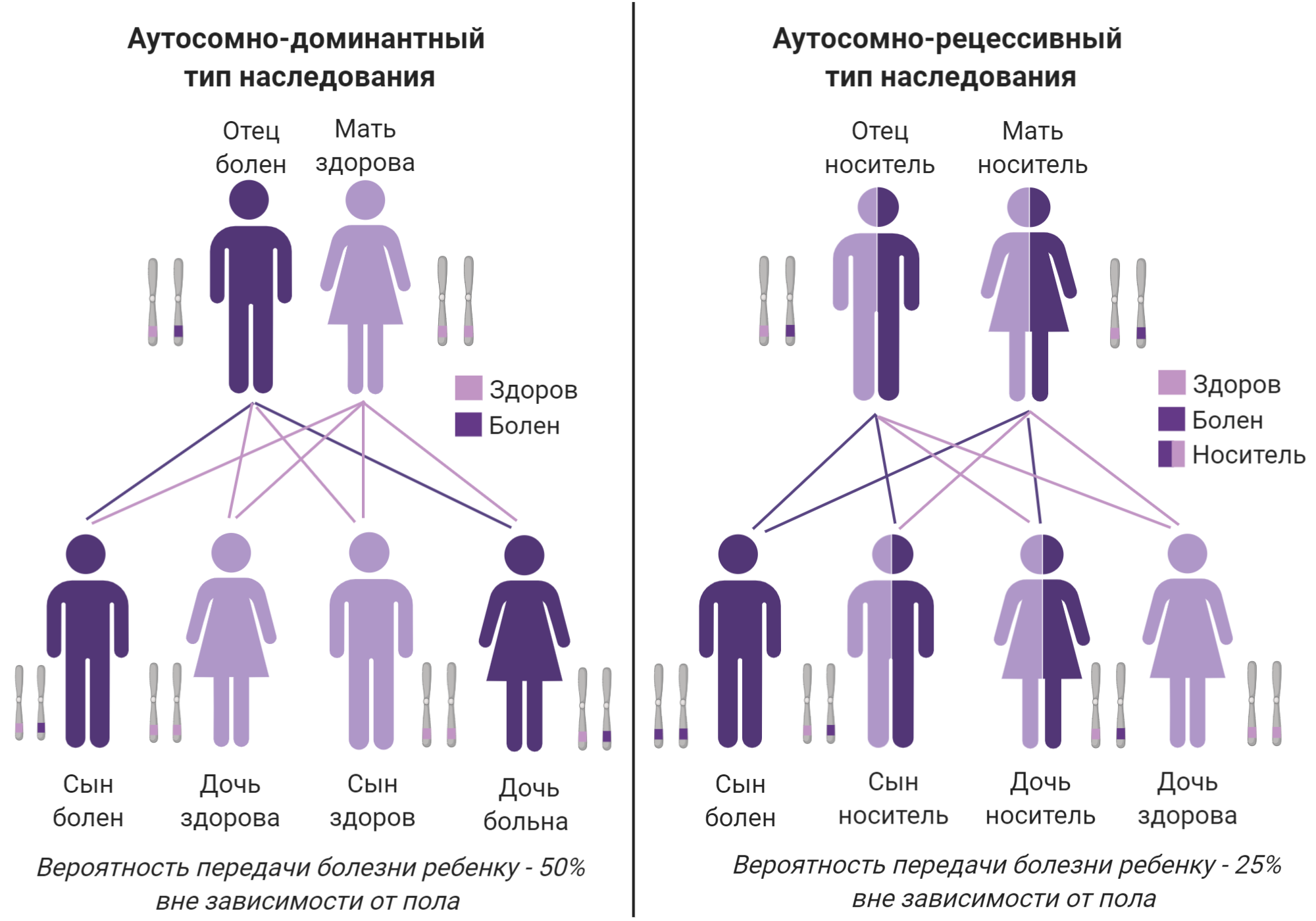
Сейчас условно принято разделять БШМТ на 4 типа в соответствии с клинической картиной (симптомами) и видом наследования (как мутация передается из поколения в поколение) 23. (Таблица 1, рис. 5). Вид наследования заболевания важно знать для планирования семьи, а также для понимания разницы тяжести симптомов у членов одной семьи.
| Тип БШМТ | Тип наследования |
|---|---|
| Тип 1 демиелинизирующий | аутосомно-доминантный тип наследования |
| Тип 2 аксональный | |
| Тип 3 болезнь Дежерина-Сотта | исторический термин, выходит из употребления, в целом обозначает сложное течение болезни и появление симптомов в раннем возрасте |
| Тип 4 демиелинизирующий | аутосомно-рецессивный тип наследования |
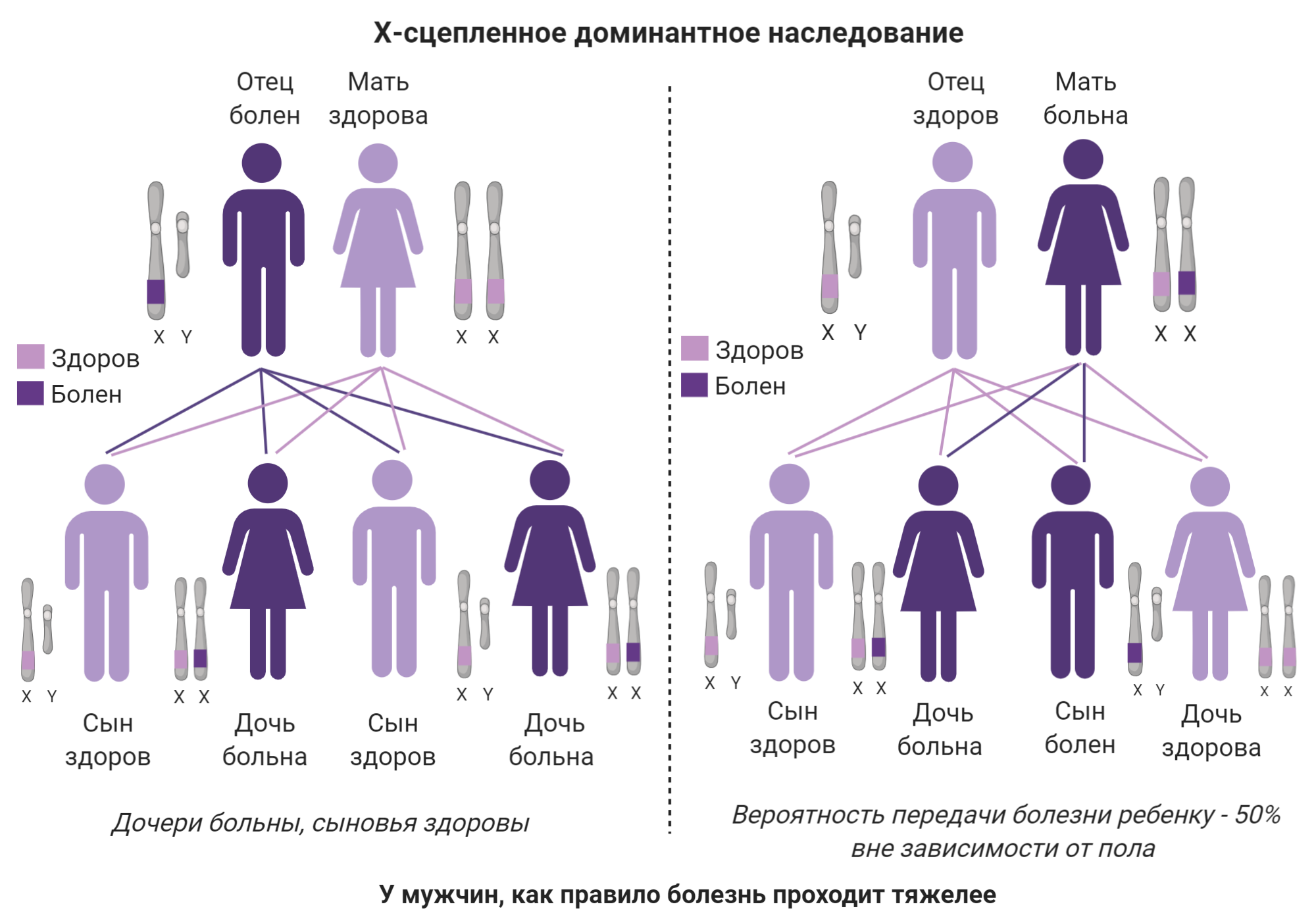
| Тип 1X промежуточный | X-сцепленный доминантный тип наследования |
Рисунок 5а. Аутосомные типы наследования БШМТ
коллаж автора статьи. Создан с помощью BioRender.com
Рисунок 5b. Х-сцепленные типы наследования БШМТ
коллаж автора статьи. Создан с помощью BioRender.com
Иногда выделяют тип 5, промежуточные и X-сцепленные типы выносят отдельно, а тип 3 почти не используется [24]. Неудивительно, что разобраться в этой классификации сложно, но, пожалуй, самое важное — понимание необходимости генетического теста для определения подтипа БШМТ. От этого зависит подбор терапии в будущем, когда она будет доступна.
Подтипы определяют гены и вид мутации в них: один и тот же подтип может быть вызван разными мутациями в одном гене, а разные мутации в одном гене могут вызывать разные подтипы. Так, дупликация гена PMP22 вызывает тип 1A, а точечная мутация — тип 1E. В то же время, известно >200 точечных мутаций в гене MPZ, которые вызывают тип 1B. Казалось бы, такое неимоверное число генов и мутаций требует разработки множества терапий, а, учитывая времязатратность разработки лекарств, ситуация с БШМТ безнадежна. Однако ряд подходов может оказаться успешным сразу для нескольких типов. К тому же мутации лишь в следующих четырех генах ответственны за подавляющее большинство случаев БШМТ: PMP22, MPZ, GJB1, MFN2. Это диктует разработку терапий именно для типов, связанных с этими генами. Итак, переходим к более подробному описанию самых распространенных типов БШМТ и разрабатываемых терапий для них.
Терапевтические подходы согласно самым распространенным типам
Периферический миелиновый белок 22 (PMP22): дупликация — тип 1A, точечная мутация — тип 1Е
Тип 1а уникален: это самый распространенный тип [25], который, в отличие от других известных типов, вызван не точечной мутацией, а дупликацией. В связи с тем, что большинство людей с БШМТ страдают именно от типа 1А, исследования, посвящённые этому типу, преобладают. Лекарства для этого типа также на самой продвинутой стадии разработки. Мы уже много всего знаем об этом типе, а история попыток его лечения наполнена драмой, но, несомненно, увидит счастливый конец. Я тоже отношусь к «счастливчикам» с этим типом и, несомненно, наполнена оптимизмом касательно разрабатываемых лекарственных терапий.
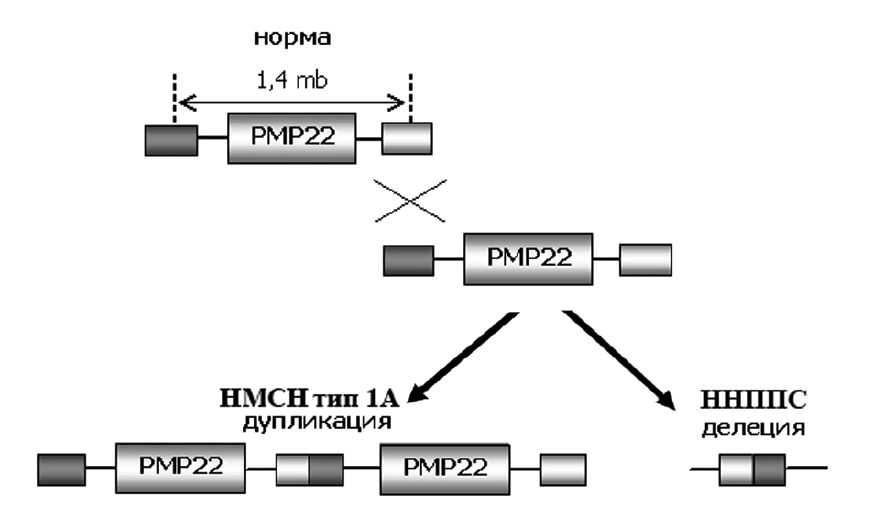
При типе 1А мутации подвержен участок хромосомы 17 (обозначается как 17p11.2-p12), где находится ген PMP22. Было показано, что изменение числа копий именно PMP22 — причина развития заболевания, несмотря на то, что в этой части хромосомы 17 находятся еще несколько генов. Делеция (потеря) этого же участка хромосомы вызывает другое заболевание ПНС с похожими симптомами [26], . Дело в том, что при делении клетки могут происходить дупликации и делеции определенных участков ДНК из-за повторяющихся элементов вокруг, что и происходит с PMP22 (рис.6).
Известное под названием наследственной нейропатии с предрасположенностью к параличам от сдавления (ННППС).
Рисунок 6. Образование двух аномальных хромосом: с дупликацией и делецией PMP22
Такие нестабильные участки ДНК так и норовят мутировать подобно непоседливым детям, которые не могут усидеть на месте. Подобного рода мутации невозможно обнаружить с помощью методов секвенирования [27] (т.е. прочтения ДНК по буквам). Поэтому используется другой подход — количественная оценка определенных маркеров внутри этого участка хромосомы методом полимеразной цепной реакции (ПЦР) [28]. Как правило, если по возрасту возникновения симптомов (подростковый), самим симптомам и результатам ЭМГ понятно, что у пациента демиелинизирующая форма заболевания ПНС, то следующим шагом будет проведение ПЦР-теста на определение копий PMP22. Если это число в норме — нужно дальше продолжать поиск мутации, вызывающей заболевание. В моём случае врач-невролог направил меня именно на ПЦР-тест, так мутация и была обнаружена. Однако иногда врачи сразу направляют пациентов на секвенирование экзома (той части генома, которая кодирует белки), что излишне и не приведёт к обнаружению мутации-причины БШМТ типа 1А.
Интересно, что даже у пациентов с одним и тем же типом заболевание протекает по-разному. Это я наблюдаю и у своих подписчиков. На это есть несколько причин. В случае типа 1А одно из объяснений разнородности тяжести заболевания — число копий PMP22. Иногда у пациентов наблюдается не дупликация, а трипликация этого участка хромосомы, т.е. производство белка PMP22 ещё выше. Это может возникнуть в случае наследования дупликации от матери, на которое накладывается ещё одна реорганизация хромосомы [29]. В таком случае симптомы намного более выражены и могут проявиться в раннем возрасте [30]. Ещё одной причиной выступает разнородность последовательностей тех участков ДНК, которые кодируют молекулы-регуляторы PMP22. Не всегда ДНК кодирует белки, а РНК выступает промежуточным шагом в этом процессе. Есть такие РНК, которые не являются шаблоном для производства белков, а сами регулируют экспрессию генов [31]. Иногда даже одной разницы в «написании» таких участков, которые регулируют экспрессию PMP22 хватает для разнородности выраженности симптомов заболевания [32].
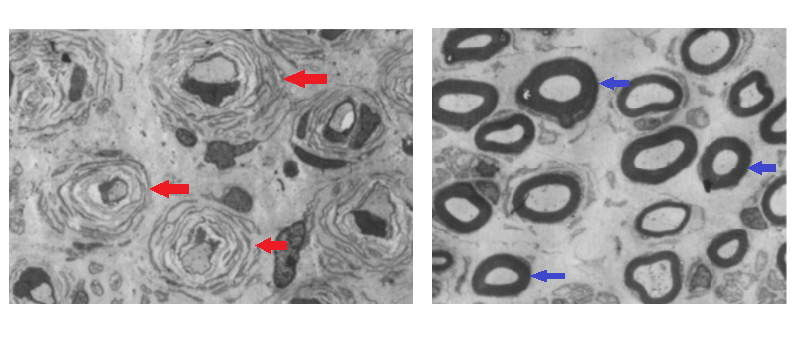
Чем же опасна эта мутация? Дупликация гена PMP22 приводит к повышенному производству соответствующих РНК и белка. Это белок мембраны Шванновских клеток, который составляет ≈2–5% миелина по весу [33]. Так же, как подъёмный кран необходим для построения высокоэтажки из блоков, PMP22 жизненно важен для формирования структуры миелина, состоящей из жиров и белков [33]. Повышенное количество PMP22 приводит к нарушению архитектуры миелина и образования так называемых «луковичных головок», окружающих аксоны [34] (рис.7).
Рисунок 7. Луковичные головки (нарушение миелина) (слева), здоровый миелин (справа)
иллюстрация адаптирована из [34]
Из-за повреждённой миелинизации нарушается проводимость нервного импульса к мышцам, поэтому становится сложно ими управлять. Сначала страдают ступни: нарушается походка, пациенты испытывают неудобство при ходьбе, подворачивания, иногда спазмы. Ввиду того, что нервный импульс не достигает мышц, они атрофируются, деформируется стопа. По мере прогрессирования заболевания могут также страдать руки: слабость в кистях, нарушение мелкой моторики, тремор, деформация кистей. Также наблюдаются отсутствие рефлексов и потеря чувствительности. Эти симптомы типа 1А известны как «классическая» симптоматика БШМТ, она характерна и для других типов [23]. Помимо стандартных симптомов, затрагивающих моторные функцию и чувствительность, БШМТ может нарушать целый ряд других функций, что может ускользать от внимания врачей. Сюда входят проблемы с дыханием и глотанием [35] (вероятно, из-за слабости мышц диафрагмы [36]), потеря слуха [37], нарушение некоторых функций внутренних органов [38] и даже нарушение ориентации в пространстве [39]. С возрастом ситуация ухудшается, особенно после 50 лет, что, вероятно, связано с добавлением дегенерации самих аксонов к уже присутствующей демиелинизации [40].
Ещё один, пожалуй, недооцененный симптом БШМТ в целом и типа 1А в частности — усталость [41]. Пациенты описывают это как отсутствие энергии, сопровождающееся волнами изнеможения [42]. Ни я, ни мои подписчики не являются исключением — мы все жутко устаем. Триггерами подобной усталости выступают стресс, физическая активность (в частности ходьба), продолжительная концентрация — в том числе для того, чтобы постоянно наблюдать за поверхностью и не споткнуться. Способов борьбы с усталостью при БШМТ фактически нет. Была показана некоторая эффективность приема лекарства модафинила [43] и интервальной велотренировки [44], но на маленьких группах людей: 4 и 8 человек соответственно. На данный момент неизвестно, что именно вызывает хроническую усталость при БШМТ. Хотя можно вынести некоторые предположения на этот счет.
В первую очередь дело, конечно, в энергии. Пациентам с БШМТ типа 1А требуется больше энергии, чем здоровым людям, для того, чтобы выполнять даже такую простую задачу как ходьба [45]. Кроме того, заболевание приводит к нарушению энергообмена: страдают митохондрии из-за пониженного производства необходимых для них белков, нарушается метаболизм белков и жиров, критически важных для синтеза миелина 47. Эти процессы приводят к оксидативному стрессу и хроническому воспалению. Интересно, что подобные процессы наблюдаются у пациентов с типом 1А, несмотря на то, что мутация в гене, казалось бы, никак не связанном с функционированием митохондрий. Есть типы БШМТ, вызванные мутациями в генах, производящих белки, жизненно важные для митохондриальной функции. В этом случае молекулярные пути, вызывающие оксидативный стресс, более понятны [48].
Терапевтические подходы 1: боремся с последствиями
Под оксидативным стрессом имеется в виду неспособность организма справляться с так называемыми свободными радикалами [49]. Это в целом плохие парни, которые пытаются «отщипнуть» электроны от других молекул, делая их нестабильными. Свободные радикалы запускают воспалительный процесс, который, по-видимому, и вызывает усталость, ведь всем знакомо чувство изнеможения, скажем, при простуде. Однако, если в случае с простудой воспаление — это ответ на инфекцию, который пройдет, как только иммунная система справится с вирусом, то в случае БШМТ воспаление так и мучает пациентов. К тому же есть данные о нарушенном функционировании иммунной системы при БШМТ [50].
В связи с этим уже давно исследователи пытаются применить антиоксиданты [49] как возможную терапию для борьбы с БШМТ. Антиоксиданты — это хорошие парни, которые делятся своими электронами и нейтрализуют свободные радикалы. Уже было опробовано несколько антиоксидантов на животных моделях типа 1А, а некоторые даже на людях.
- Витамин C (аскорбиновая кислота). Ожидалось, что это будет первым лекарством для БШМТ. На него возлагали большие надежды, ведь в дополнение к антиоксидантному воздействию витамина Ц, была показана его способность снижать уровень PMP22[51]. Он отлично сработал на животных [52]. По всему миру было запущено несколько клинических исследований для оценки эффективности витамина Ц на людях, но, увы, его ожидал провал [53], [54].
- Мелатонин — не только регулятор цикла сна-бодрствования, но и мощный антиоксидант, успешно снизивший воспаление у трёх детей с БШМТ типа 1А [55]. Это пилотное исследование обнадёживает, но необходимо дождаться результатов исследований на большем количестве пациентов.
- Куркумин примечателен не только своей способностью окрашивать куркуму в столь яркий жёлтый цвет, но и своими противовоспалительными и антиоксидантными свойствами. На крысах было показано, что куркумин (но не обычный, а специально разработанный, доставляемый в организм с помощью наночастиц) снижает оксидативный стресс и улучшает миелинизацию и моторные функции при типе 1А [56]. Вероятно, что наподобие витамина Ц куркумин ожидает фиаско при тестировании на людях. Хотя не исключено, что такая терапия увенчается успехом. В любом случае необходимо ждать исследований на людях.
Оксидативный стресс непосредственно связан с другим видом стресса — стрессом эндоплазматического ретикулума (ЭР)). ЭР — станция клетки, где белки сворачиваются, то есть приобретают необходимую для их нормального функционирования структуру. Действительно, при БШМТ типа 1А наблюдается повышенный стресс ЭР и нарушение сворачивания PMP22 [57]. В связи с этим ещё один разрабатываемый терапевтический подход для типа 1А — корректировка стресса ЭР, чем занимается компания InFlectis BioScience. Разработанная ими малая молекула под кодовым названием IFB-088 уже прошла испытания на здоровых добровольцах. Клинические исследования для оценки эффективности молекулы на пациентах с БШМТ начнутся в 2021 году.
Неправильно свернутые белки PMP22 могут образовывать токсичные скопления внутри клеток, что нарушает их функционирование. Следовательно, деградация таких скоплений — ещё один возможный терапевтический подход. Его можно осуществить путем стимуляции аутофагии [58] — естественного процесса, с помощью которого клетка избавляется от всего ненужного. На животных было опробовано два варианта такого подхода: интервальное голодание, когда животные получали еду через день [59], и применение лекарственного препарата рапамицина [60], [61]. В случае последнего миелинизация улучшилась, а моторные функции — нет.
Ещё одно, мягко говоря, неприятное последствие дупликации гена PMP22 — нарушение метаболизма жиров, которые так необходимы для нормального функционирования миелина [46]. Недостаточное их производство подтолкнуло исследователей к тестированию специальной диеты на модельных животных с БШМТ типом 1А. В результате добавления фосфолипидов в питание крыс, ученым удалось добиться улучшения состояния миелина, аксонов, мышц и моторной функции [47]. Будем ждать результатов воссоздания подобной диеты на пациентах с БШМТ 1А. Пока же пациентам с БШМТ целесообразно следовать общим рекомендациям правильного питания, которые я подробно рассматриваю на своём YouTube-канале.
Терапевтические подходы 2: искоренение проблемы
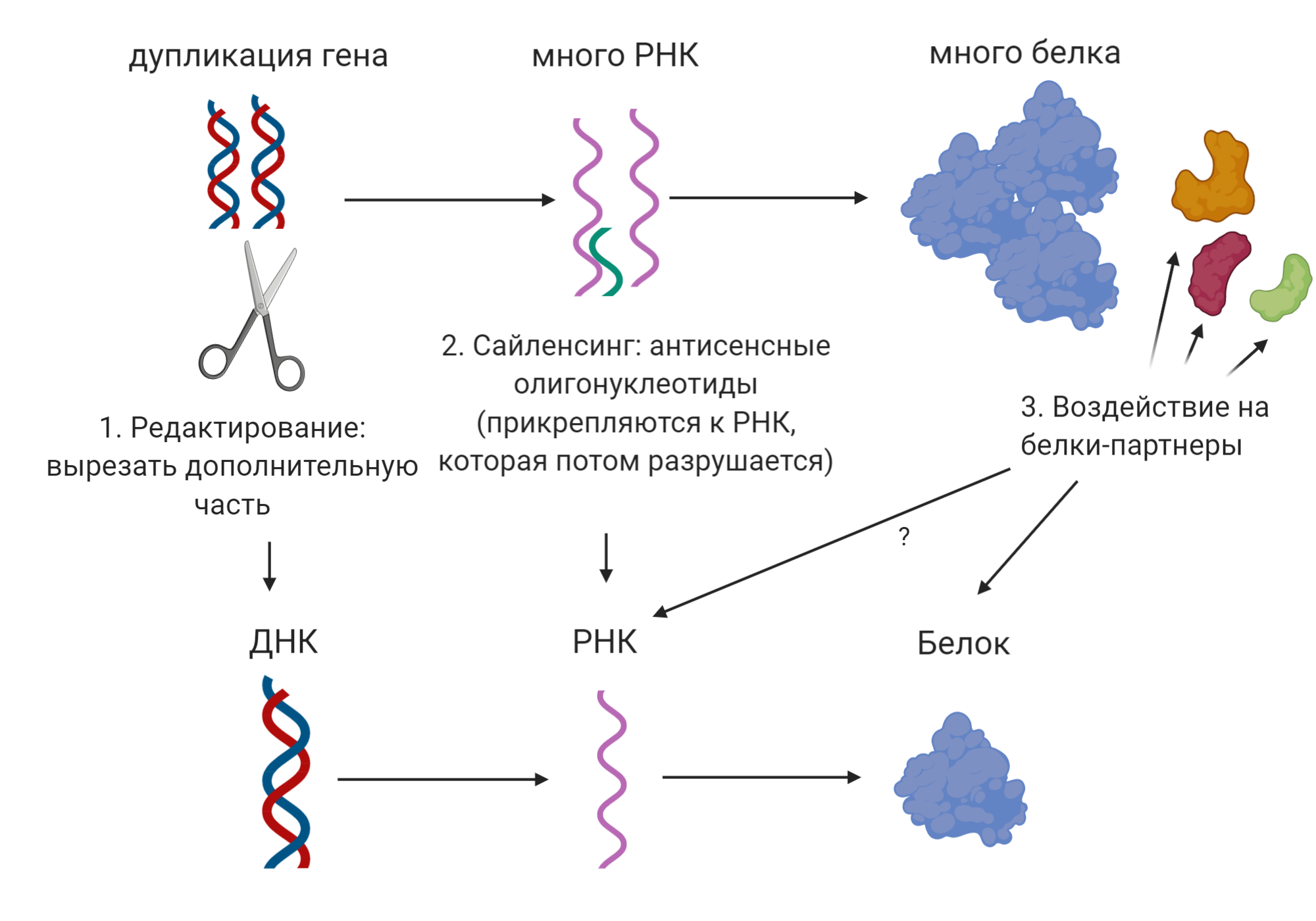
Несмотря на разнообразие разрабатываемых терапевтических подходов, упомянутых выше, самым многообещающим на данный момент выступает снижение экспрессии PMP22. Здесь опять же существует несколько вариантов решения проблемы: корректировка гена, воздействие на РНК или на белки-регуляторы и партнёры белка PMP22 рис. 8). Некоторые из них пока помогли только животным, а некоторые уже вышли на финишную прямую.
Рисунок 8. Терапевтические подходы для лечения БШМТ типа 1А путем искоренения проблемы
коллаж автора статьи. Создан с помощью BioRender.com
Пожалуй, самое очевидное решение проблемы — генное редактирование, ведь если проблема в мутации, то, починив её, мы сможем искоренить непосредственно причину заболевания. Действительно, совсем недавно на мышиной модели типа 1а был опробован метод генетического редактирования с помощью системы CRISPR/Cas9. Исследователям удалось успешно вырезать часть гена PMP22, снизив его экспрессию на ≈40% без внесения каких-либо нецелевых изменений в гены животных [62]. Для того, чтобы опробовать данный подход на людях, необходимо решить несколько проблем, включая эффективную доставку системы в шванновские клетки пациентов. Авторы работы предполагают, что этот терапевтический подход может оказаться эффективным при применении как в раннем возрасте, до начала демиелинизации, так и при уже начавшейся деградации миелина. Однако вопрос о том, сможет ли такая терапия откатить назад уже накопившиеся повреждения разного рода (описанные выше) у пациентов взрослого возраста, остаётся открытым.
Ещё один вариант снижения уровня PMP22 — воздействие на РНК, т.е. промежуточный шаг между производством белка PMP22 из одноименного гена. Такой подход известен как РНК-интерференция [63]. Наши клетки привыкли к тому, что РНК у них одноцепочечная, а, если они вдруг сталкиваются с тем, что РНК стала состоять из двух цепочек, то они избавляются от такой странной молекулы. Этот подход оказался успешным не только на мышах, но и на крысах. Исследователям удалось снизить производство PMP22 и улучшить моторные функции животных [64]. По всей видимости, воплощению данного подхода на людях мешает опять же проблема доставки терапии в клетки человека. Хорошая же новость состоит в том, что уже несколько фармкомпаний решают эту проблему, в том числе Ionis Pharmaceuticals [65] и DTx Pharma [66].
Были попытки регулировать уровень PMP22 с помощью манипуляций с белками, которые влияют на производство PMP22. Например, воздействуя на половой гормон прогестерон. Было показано, что прогестерон повышает уровень PMP22; соответственно, снизив активность первого, снизим и выработку второго. Такой подход, использующий блокатор рецептора прогестерона и не даёт тем самым прогестерону воздействовать на него, оказался удачным на животных 68. Однако подобные лекарства показали токсичность для людей, поэтому ещё не было ни одного клинического исследования для оценки их эффективности на пациентах с БШМТ [69].
Ещё одна рассматриваемая мишень воздействия для снижения производства PMP22 — нейрегулин-1 — белок, регулирующий активность шванновских клеток. На грызунах был показан положительный эффект дополнительного применения нейрегулина-1 для улучшения состояния аксона [70]. Однако, как замечают авторы другой статьи, существует несколько вариантов нейрегулина-1, и некоторые из них производятся в повышенном количестве при БШМТ типе 1А [71]. Поэтому, прежде чем повышать уровень нейрегулина-1 у пациентов, необходимо разобраться, какие варианты нужно использовать и перспективный ли это подход вообще.
Другим путём пошли исследователи, которым в итоге удалось разработать лекарство, которое работает на людях. Вместо того, чтобы выбирать какую-то одну мишень, воздействие на которую приведет к снижению экспрессии PMP22, они решили проанализировать сигнальные пути, в которых участвует этот белок. Каждый белок в нашем организме общается с целым рядом других белков, создавая тем самым сети сигнальных путей наподобие тому, как люди взаимодействуют в социальных сетях. Проанализировав сигнальные пути PMP22, учёным удалось подобрать комбинацию из трёх уже одобренных для других заболеваний лекарств, которая бы воздействовала на белки-партнеры PMP22 и снижала бы его производство. После того, как были получены обнадеживающие результаты на грызунах [72], было проведено исследование на пациентах с БШМТ типом 1A, которое также увенчалось успехом, показав, что моторные функции пациентов улучшились [73]. Важно, что для достижения желаемого эффекта необходима комбинация из всех трёх препаратов — баклофена, налтрексона и сорбита [74].
Также есть основания полагать, что применение лекарства в детском возрасте, до развития симптомов, может отсрочить или даже предупредить проявление заболевания [75]. Pharnext — компания, разрабатывающая препарат, — уже провела часть финальной третьей фазы клинического исследования для оценки эффективности данного лекарства, известного под кодовым названием PXT3003. Заключительная часть этого исследования запланирована на 2021 год, и, очень вероятно, это будет самым первым лекарством для БШМТ, которое выйдет на рынок. Это, безусловно, будет прорывом, которого так ждут пациенты. Прорывом, достигнутым с помощью силы новых технологий, в том числе искусственного интеллекта, алгоритмы которого способны анализировать большое число молекул-участников клеточного общения и подбирать методы воздействия на них. О, этот дивный новый мир!
Различного рода генная терапия [76] тестируется пока только на животных. Здесь уже речь не о направленном воздействии на сам PMP22 (генное редактирование), а о доставке другого белка — нейротрофина-3 (НТ-3) — к демиелинизированному аксону. НТ-3 производится шванновскими клетками и способствует регенерации поврежденных аксонов. Предположение ученых состояло в том, что, снабдив дегенерирующие аксоны при БШМТ типе 1А дополнительным количеством белка НТ-3, возможно будет их восстановить. После успешного тестирования этого подхода на мышах, ученые запустили пилотное исследование с подкожными инъекциями НТ-3 на людях и даже получили положительные результаты. Однако, ввиду ряда проблем, назрела необходимость пересмотра подхода. Выходом стала доставка не белка, а гена НТ-3 с помощью вирусной «оболочки» [77] — отработанный метод доставки генетического материала в клетки. В декабре 2020 планируется запустить клиническое исследование для оценки эффективности одноразовой инъекции НТ-3 генной терапии пациентам с БШМТ типом 1А. Примечательно, что данный подход может оказаться успешным и для других типов БШМТ, ведь он направлен на восстановление аксона [78], который так или иначе страдает при всех типах заболевания. Это касается и типа 1Е, вызванного точечной мутацией в том же гене, что и при типе 1А — уже так знакомом нам PMP22.
Белок коннексин-32 (GJB1): тип 1Х
Тип 1X — второй по распространённости тип БШМТ, который составляет примерно 7% всех случаев. Этот тип интересен тем, что вызван мутациями в гене, расположенном на половой X-хромосоме (отсюда название). У женщин таких хромосом две, а у мужчин одна Х и одна Y-хромосома. Это обусловливает необычность его наследования по сравнению с другими известными типами и разницу в выраженности симптомов в зависимости от пола пациента. Как видно на рис. 5b, если болен отец, то все его сыновья будут здоровы. Такой гарантии нет при любом другом типе. Также симптомы у женщин с этим типом часто менее выражены, чем у мужчин [79] (вероятно, из-за инактивации той X-хромосомы, где находится мутированный ген). Ввиду того, что у женщин две X-хромосомы, одна из них случайным образом инактивируется, чтобы предупредить чрезмерное производство генов, на них расположенных. Однако, если инактивированной хромосомой стала та, которая содержит здоровый ген, тогда и симптомы будут более выраженными. У мужчин же нет бэкапа в виде второй X-хромосомы; соответственно, выраженность симптомов у мужчин более однородна и чаще сильнее, чем у женщин даже из той же семьи.
Этот тип вызван разными мутациями в гене GJBI (их известно уже >400), который кодирует белок коннексин-32. Коннексины — белки, которые располагаются в мембране клеток и образуют структуры, выполняющие роль молекулярных связок между клетками [80]. С помощью таких связок клетки общаются путём обмена малыми молекулами. Известен целый ряд коннексинов, но нас интересует именно коннексин-32: это важный соединительный элемент между слоями миелина и между аксоном и миелином. Важно, что этот белок производится не только в ПНС, но и в ЦНС, и даже в печени [81]. Есть также данные об участии коннексина-32 в функционировании митохондрий. Ввиду многофункциональности и экспрессии коннексина-32 в разных тканях, мутации в кодирующем его гене могут приводить к симптомам, не ограниченным ПНС. Так, у мышиной модели типа 1Х наблюдается дисфункция олигодендроцитов (помним, что они производят миелин в ЦНС), стресс ЭР и воспаление [82]. У некоторых людей также наблюдаются симптомы, связанные с нарушением ЦНС: глухота и нарушение когнитивных функций, часто эпизодически [83].
В числе терапевтических подходов, уже опробованных на животных моделях типа 1Х, — генная терапия [76]. Однако, в отличие от типа 1А, здесь речь идёт о доставке здоровой версии самого виновника заболевания — GJBI 84. Такой подход сработал на животных не только до развития у них симптомов, но и после [84]. У мышей значительно улучшились моторные функции и миелинизация, а также снизилось воспаление. Следующий шаг — оптимизация доставки гена в клетки людей и запуск клинических исследований.
Нулевой миелиновый белок (MPZ, P0): тип 1В и тип 3
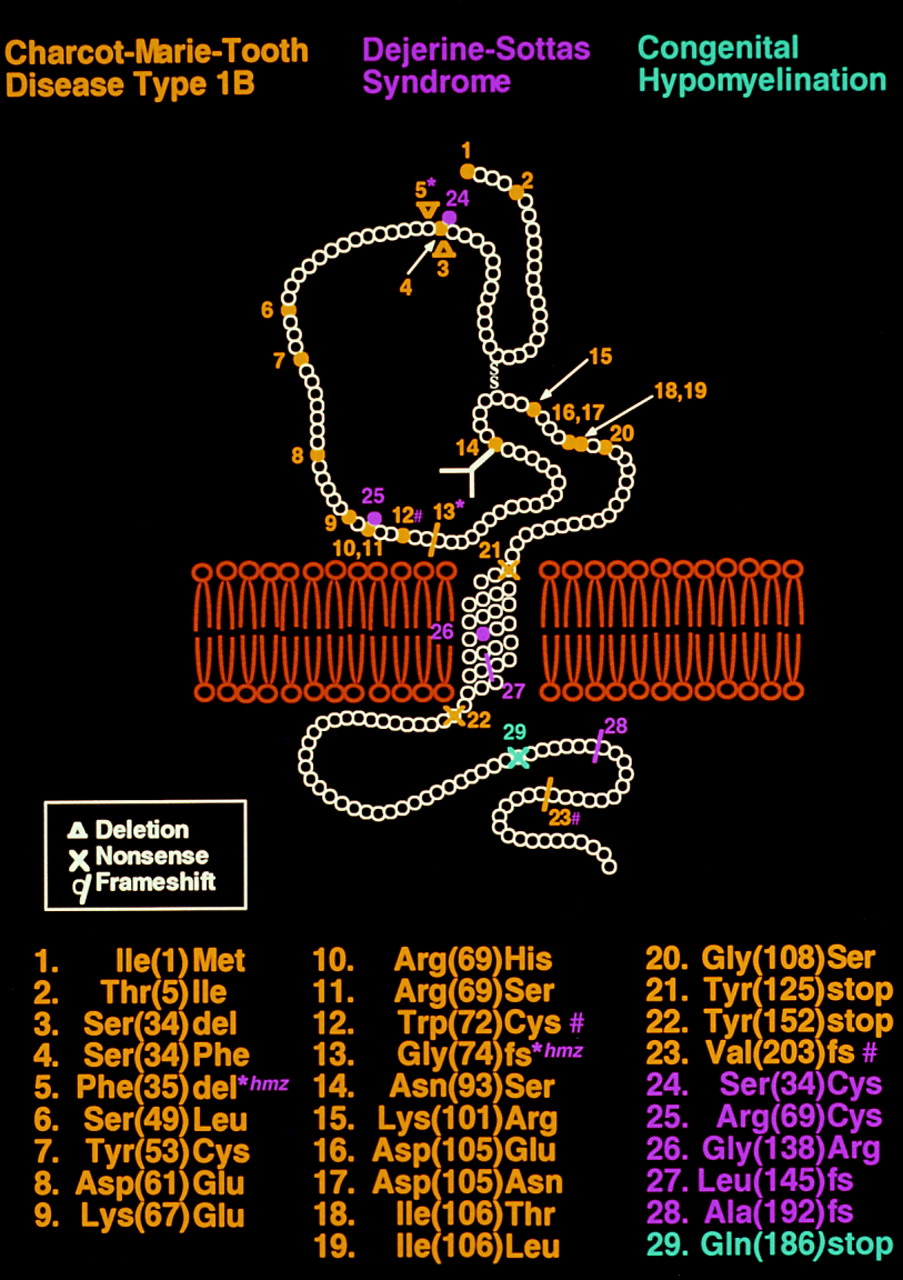
Тип 1В составляет 5–10% случаев БШМТ демиелинизирующей формы и вызван мутациями в гене MPZ. Этот ген кодирует белок, который составляет около 50% всех белков миелина в ПНС [85]. Трансмембранный белок MPZ производится исключительно шванновскими клетками и выступает важнейшим структурным белком миелина. В зависимости от того, где именно мутация, белок будет либо совсем не функционален, либо «наполовину». Разные точечные мутации в гене MPZ приводят к БШМТ 1В (уже известно ≈30 мутаций) (рис. 9), что обусловливает разнородность тяжести и возраста проявления симптомов. Около 5–10% людей с БШМТ 1 типа относятся к типу 1В [23].
Рисунок 9. Трансмембранный белок MPZ. Жёлтым цветом выделены мутации, связанные с БШМТ 1В. Сиреневым цветом выделены мутации, приводящие к БШМТ типа 3.
В целом внутри подтипа 1В выделяют две группы пациентов: одну с ранним проявлением заболевания и тяжелыми симптомами, включая задержку ходьбы, и другую — с более лёгкими симптомами, которые проявляются во взрослом периоде жизни. По симптомам тип 1В очень похож на тип 1А, а действительно хорошая новость состоит в том, что некоторые терапевтические подходы могут подойти для обоих типов.
Во-первых, уже знакомый нам антиоксидант куркумин, растворённый в кунжутном масле, показал успех на мышиной модели типа 1В [87]. Оказалось, что куркумин играет роль не только антиоксиданта, но и снижает стресс эндоплазматического ретикулума. Как мы уже обсудили ранее, неправильно свернутые белки вызывают стресс ЭР. Мутации в гене MPZ приводят к нарушению нормальной структуры произведенного белка, и, соответственно, снижая стресс ЭР, мы боремся со следствием заболевания. А уже упомянутая Inflectis BioScience планирует опробовать свою малую молекулу IFB-088 не только на пациентах с типом 1А, но и 1В.
Во-вторых, ещё один общий подход, вселяющий надежду для разных типов БШМТ, в том числе 1В, — подавление программы дегенерации аксона [88]. Дело в том, что при разного рода повреждении у аксонов запускается программа разрушения, которая характерна для разных типов БШМТ. Подавив эту программу путём воздействия на её белки-участники, теоретически можно остановить дегенерацию аксона при БШМТ. Исследователи рассматривают разные варианты воздействия на эту программу и уже опробовали несколько из них на мышиных моделях типа 1А и 1В. Такая терапия может оказаться успешной как вспомогательная для тех, которые направлены непосредственно на искоренение проблемы, т.е. соответствующий мутированный ген. А вот для аксональной формы (разных подтипов типа 2) БШМТ подобный подход обещает быть особенно успешным, ведь у таких пациентов в первую очередь страдает аксон.
Митофузин-2 (MFN2): тип 2А
Мы перешли на аксональные подтипы БШМТ. Терапии в разработке для этих подтипов не на таком продвинутом уровне, но радует, что хотя бы разработаны животные модели для разных подтипов типа 2. А это уже достижение и приближает исследователей к апробации терапий на животных. Опять же, уровень продвинутости подходов зависит от распространенности подтипа.
Тип 2А вызван мутациями в гене MFN2, который кодирует белок митофузин-2, и ответственен за 30% всех случаев типа 2. О функции этого белка легко догадаться из его названия: «мито» означает митохондрии, а «фузин» (от англ. fusion) — слияние. Соответственно, митофузин-2 необходим для важного процесса слияния митохондрий. С помощью разных белков, в том числе митофузина-2, расположенного в мембране митохондрий, энергетические станции наших клеток формируют динамичные сети, обеспечивая энергией разные участки клетки, где она нужна в тот или иной момент. В частности, таким образом митохондрии общаются с ЭР.
Митофузин-2 производится в разных клетках, но нейроны особенно чувствительны к дефектам этого белка. Для нормального функционирования нейронам жизненно важно вовремя получать энергию в той части клетки, которая активна. Мутации же в гене MFN2 могут нарушать функционирование белка, тем самым нарушая и формирование сетей митохондрий, и вызывая ЭР стресс нейронов. К тому же в нервной системе производство митофузина-1 (своего рода бэкапа митофуниза-2) ниже, чем в других тканях.
Было обнаружено уже более 100 мутаций в гене MFN2, которые вызывают БШМТ типа 2А. Опять же: выраженность симптомов и возраст их проявления варьируется у пациентов даже с одной и той же самой мутацией [89]. Дегенерация же аксонов наблюдается у всех пациентов, что обуслoвливает ожидаемую пользу подавления программы дегенерации аксонов, описанную выше.
Есть некоторые отрывочные данные о положительном эффекте использования антиоксиданта коэнзима Q10 [90], но необходимы более обширные исследования для каких-либо выводов.
Разработкой еще одного подхода занимается компания AcuraStem. В процессе скрининга молекул-кандидатов на клетках, взятых у пациентов с БШМТ типом 2А, исследователи обнаружили молекулу, которая способствует выживаемости нейронов. Сейчас же, наподобие Pharnext, компания проводит скрининг уже одобренных для других заболеваний компонентов, ожидая найти среди них те, которые сработают для типа 2А. Такой подход поможет сократить время разработки лекарств, ведь их безопасность уже показана [91].
Среди разрабатываемых терапевтических подходов для этого типа опять же генная терапия [76]. Здесь рассматривается несколько подходов: увеличение производства митофузина-1 или митофузина-2 [92], например, путем доставки здорового гена; комбинация подавления производства белка из мутированного гена (путём воздействия на РНК наподобие того, как это делается в случае типа 1А) и добавление здорового гена MFN2 [93]. Пока эти методы в процессе тестирования на животных.
Итак, мы рассмотрели терапевтические подходы для лечения самых распространённых типов БШМТ, направленные на борьбу с мутациями в четырёх генах. Похожие подходы, в частности генная терапия, находятся в разработке и для других подтипов БШМТ. Так, например, еще один аксональный тип 2E планируют лечить с помощью инактивации мутированного гена и доставки здорового его варианта [94]. Ген-виновник в этом случае известен как NEFL, он кодирует структурный белок нейронов — нейрофиламент.
БШМТ — заболевание ПНС и не затрагивает ЦНС. Так ли это?
Как мы уже упомянули, иногда генетические мутации, вызывающие БШМТ, затрагивают и ЦНС (например, в случае типа 1Х [95]). Как правило, это происходит из-за того, что ген-виновник производит неправильной белок как в ПНС (шванновскими клетками), так и в ЦНС (олигодердроцитами). Так, у некоторых пациентов с типом 1Х обнаруживаются структурные нарушения белого вещества (миелина) головного мозга, а среди симптомов, длящихся от нескольких часов до нескольких недель, могут быть нарушения зрения, слуха, координации, проблемы с речью, головокружение. Часто на это накладывается воспаление, вероятно, связанное с аутоиммунным ответом (когда иммунитет атакует собственный организм) [96]. В целом возникает картина рассеянного склероза [2], однако, важно понимать, что все эти симптомы вызваны БШМТ.
Помимо типа 1Х, некоторые нарушения миелина ЦНС были обнаружены у нескольких пациентов с типом 1А [97]. Хотя не исключено, что в этих случаях у пациентов присутствует и БШМТ, и рассеянный склероз. Однако разница в структуре мозга людей с этим типом БШМТ и здоровых людей всё же есть, несмотря на то, что белок PMP22 производится в ЦНС в ничтожном количестве. У таких пациентов наблюдается в целом меньший объем белого вещества в мозге, но повышенный объём серого вещества (нейронов) в регионах мозга, ответственных за координацию движений, походку и баланс [98]. Вероятно, таким образом происходит компенсация дефицита периферической нервной системы. Демиелинизация нейронов ЦНС также была обнаружена у пациентов с типом 1А [99].
Тип 2А также характеризуется вовлечённостью ЦНС: у пациентов с мутациями в гене MFN2 присутствуют повреждения как белого, так и серого вещества [100]. Напротив, при типе 4D (мутация в гене NDRG1, кодирующем белок, играющий важную роль в функционировании миелина) наблюдаются нарушения только белого вещества [101].
Поддерживающая терапия при БШМТ
Что же делать пациентам БШМТ в ожидании разработки лекарств и выхода их на рынок? Вариантов немного, но некоторые из них могут значительно улучшить качество жизни и приостановить прогрессирование болезни.
- Физиотерапия и физические упражнения разного характера, включая силовые тренировки, кардио и упражнения на гибкость [102].
- Вспомогательные средства, такие как ортезы для стабилизации голеностопа и стопы [103].
- Хирургические операции при значительных деформациях конечностей и позвоночника [104].
- Нет данных, подтверждающих эффективность и оценивающих безопасность следующих процедур у пациентов с БШМТ: санаторно-курортное лечение (грязи, ванны, массажи), электрофорезы, магнитная терапия, электростимуляция, методы нетрадиционной медицины. Однако, к сожалению, эти процедуры часто назначаются пациентам в России.
- Пациенты с БШМТ должны наблюдаться у мультидисциплинарной группы врачей, которая способна подобрать индивидуализированный подход к каждому пациенту.
Мировые активности, посвященные БШМТ
Пациенты с БШМТ могут поучаствовать в клинических исследованиях, если они были запущены в стране проживания, следить за деятельностью организаций, посвященных БШМТ, и даже просто установить приложение CMT&me, тем самым предоставляя важную для исследователей информацию о прогрессировании заболевания. К сожалению, приложение могут установить только граждане определённых стран Европы и США, но данные, собранные таким образом, несомненно, помогут лучше понять БШМТ, распространённость различных типов, симптомы и т.д. Несомненно, это поможет увидеть более полную картину БШМТ и обеспечит врачей во всем мире необходимыми знаниями для предоставления качественной помощи пациентам.
Следующие организации, созданные самими пациентами, собирают средства на поддержку исследований для разработки лекарств для БШМТ, информируют пациентов о новостях и организуют встречи, создавая БШМТ-сообщества:
- Charcot-Marie-Tooth Association (США) — пожалуй, самая глобальная БШМТ-организация.
- Hereditary Neuropathy Foundation (США)
- CMT Research Foundation (США)
- The European Charcot-Marie-Tooth Federation (Европа) — федерация нескольких европейских ассоциаций, посвященных БШМТ. Вступить могут как оформленные некоммерческие европейские организации (full member), так и ассоциации из других регионов (associate member).
- The Charcot Marie Tooth Association Australia Inc (Австралия).
- Есть некоторые менее масштабные ассоциации и сообщества, посвященные БШМТ в разных странах с рабочим языком страны. Например, в России «Мир без болезни Шарко-Мари-Тута — Генетика» или в Японии CMT友の会.
Заключение
БШМТ, несомненно, интереснейшее заболевание. Мы ещё только начинаем узнавать механизмы, симптомы и проявления разнообразных его типов. Однако за последние 10 лет прямо на моих глазах произошло необыкновенное: было открыто много новых подтипов БШМТ, были разработаны животные модели для самых (и не самых) распространенных из них, опробованы несколько терапевтических подходов, одно лекарство вышло на финишную прямую, а генная терапия, вероятно, в не столь далеком будущем избавит мир от БШМТ, чего так ждут пациенты по всему миру. Скорее всего, эффективная терапия для БШМТ будет подбираться под пациента и зависеть от нескольких факторов: типа, возраста, пола, степени прогрессии и особенностей генома. Будущее, несомненно, за персонализированной медициной [105], и даже, казалось бы, такое моногенное заболевание (когда виновник — один ген) как БШМТ, скажем, типа 1A, требует разного подхода ввиду вариативности симптомов и прогрессии заболевания пациентов.
Источник